Мембрана под фундаментную плиту: Профилированная мембрана под фундаментную плиту. Система плитного фундамента для частного дома с применением мембран planter от технониколь
Профилированная мембрана под фундаментную плиту. Система плитного фундамента для частного дома с применением мембран planter от технониколь
При строительстве любого здания мы неизбежно сталкиваемся с таким понятием, как подбетонная подготовка. Она выполняется из низкомарочного бетона, с целью получения ровной поверхности, чтобы в дальнейшем можно было проводить гидроизоляционные работы. При возведении зданий с низким уровнем грунтовых вод применяется только противокапелярная горизонтальная гидроизоляция фундаментной плиты. В таком случае можно избежать сложных. дорогостоящих работ по созданию бетонной подготовки, а использовать профилированную мембрану Planter.
Использование мембраны Planter для замены подбетонной подготовки позволит Вам:
- избежать затрат времени на устройство бетонной подготовки;
- обеспечить высокие темпы производства работ;
- существенно упростить работы;
- защитить фундамент;
- и даже здать объект раньше срока!
Профилированная мембрана Planter создает оптимальные условия для твердения бетона. т.к. необходимое бетону «цементное молоко» не уходит в грунт. Шипованная поверхность мембраны придает ей необходимую жесткость, что позволяет укладывать непосредственно на нее арматурный каркас и бетонировать.
т.к. необходимое бетону «цементное молоко» не уходит в грунт. Шипованная поверхность мембраны придает ей необходимую жесткость, что позволяет укладывать непосредственно на нее арматурный каркас и бетонировать.
Площадь поверхности мембраны Planter больше чем, площадь поверхности ровного материала на 25%, за счет выступов. Например: на 1 м² грунта можно уложить 1 м² бетонной подготовки, соответственно когда мы уложим фундамент, он будет давить на 1 м² грунта. А если мы вместо бетонной подготовки уложим Planter standard или extra, то фундамент будет давить на 1,25 м² мембраны и на 1 м² грунта.
При одиноковом весе фундамента, давление на грунт будет меньше там, где давление распределено на большую площадь, тоесть там где используется Planter. Говоря простым языком — чем больше площадь поверхности, тем меньше давление на нижележащие слои основания. Так же шипованная поверхность мембраны создает дополнительное трение в основании, сдерживающее трещинообразование плиты.
Порядок выполнения работ
- Укладка профилированной мембраны Planter standard и Planter extra осуществляется после нивелировки и трамбовки грунта (щебня).
 избежать затрат времени на устройство бетонной подготовки.
избежать затрат времени на устройство бетонной подготовки. - Измерьте длину и ширину поверхности, которую необходимо покрыть мембраной, затем отрежьте необходимое количество материала.
- Уложите мембрану выступами вниз с перехлестом на продольных швах — 7-10 см, на поперечных — 20 см.
- Проклейте шов сверху самоклеющейся герметизирующей лентой Nicoband шириной 20 см, либо склейте края мембраны внахлест с помощью ленты Nicoband DUO шириной 10 см. При любом способе необходимо соблюдать ширину нахлеста швов.
- Поперечные швы должны быть смещены относительно друг друга не менее чем на 50 см.
- Монтируйте арматуру на фиксаторах (пластиковые ножки для арматуры, обычно поставляются вместе с арматурой или крепежом к ней) непосредственно на мембране Planter.
Потенциальный срок службы профилированной мембраны Planter более 50 лет.
Применение данной технологии одобрено экспертизой «ЦНИИПромзданий».
Схема расположения материалов при выполнении работ по замене подбетонной подготовки мембраной «Planter standard» или «Planter extra».
- Нивелированный утрамбованный грунт.
- Профилированная мембрана «Planter standard» или «Planter extra» (выбор мембраны зависит от нагрузок, которые будут действовать на основание).
- Самоклеящаяся герметизирующая лента Nicoband DUO.
- Фундаментная плита.
- Гидрошпонка ТН ВР 240.
Сопутствующие материалы
Гидроизоляционные ленты Nicoband (Никобенд)
Ленты Nicoband представляет собой ленты из самоклеящегося битумного слоя и алюминиевого покрытия и защитной пленки. Идеально подходят для заделки швов и стыков, ремонта трещин, дополнительной шумо- и гидроизоляции, а также защиты от коррозии.
Пожалуй, только многофункциональная система защиты и гидроизоляции «Тефонд» способно справиться с проблемой гидроизоляции, практически, любых строительных конструкций.
Сегодня речь пойдет о такой уникальной возможности этой системы, как замена бетонной подготовки.
Обычно, в строительной практике, плиты фундаментов и плиточные полы укладывают на специально подготовленное основание. Это основание делается из, так называемого, «тощего бетона», в котором значительно, относительно объемов компонентов товарного бетона, уменьшены пропорции цемента и воды, и увеличено содержание наполнителя: щебня и гравия. Ровная поверхность, получаемая с помощью слоя «тощего бетона», толщиной 15-20 см, служит основанием для плит фундамента.
Это основание делается из, так называемого, «тощего бетона», в котором значительно, относительно объемов компонентов товарного бетона, уменьшены пропорции цемента и воды, и увеличено содержание наполнителя: щебня и гравия. Ровная поверхность, получаемая с помощью слоя «тощего бетона», толщиной 15-20 см, служит основанием для плит фундамента.
Обустройство этого основания и носит название «бетонная подготовка». Укладка такого основания требует выполнения соответствующего объема выемки грунта, его вывоза со строительной площадки, доставки бетона, выполнения бетонных работ при определенных погодных условиях и выдержки основания в течение определенного промежутка времени. Эти работы дороги, их сложно планировать по времени выполнения, они часто приводят к нарушению графиков строительства объектов.
Использование многофункциональная система защиты и гидроизоляции «Тефонд» — это альтернатива описанной бетонной подготовки. Геомембраны «Тефонд», «Тефонд Плюс» и «Тефонд НР», выполняют функции стабилизирующего, разделительного и изолирующего слоя конструкции.
Такой метод весьма удобен с практической и технической точек зрения, а также дает ощутимые экономические преимущества. Геомембраны системы «Тефонд» защищают бетон от влаги, а также от химического и биологического воздействия окружающей среды.
Профилированная мембрана «Тефонд» создает оптимальные условия для твердения бетона, т.к. необходимое бетону «цементное молоко» не уходит в грунт. Профилированная поверхность мембраны придает ей необходимую жесткость, что позволяет укладывать арматурный каркас непосредственно на неё и бетонировать. Площадь поверхности «Тефонд», за счет выступов, превышает, аналогичную по периметру ровную поверхность на 25%.
Соответственно, чем больше площадь поверхности, тем меньше давление на нижележащие слои основания. Шипованная поверхность мембраны создает дополнительное трение в основании, сдерживающее трещинообразование плиты. И, естественно, укладка мембраны «Тефонд» это – многократная экономия времени, по сравнению с работами по обустройству бетонной подготовки.
Ниже приведены принципиальные схемы укладки фундаментных плит «классическим методом» — «на тощий бетон», а также, с применением геомембран «Тефонд», которые, по сути, заменяют слой «тощего бетона» и делают это гораздо эффективнее, являясь, что очень важно, надежной гидроизоляцией (для увеличения кликните на изображении).
Такая технология, замена бетонной подготовки многофункциональной системой гидроизоляции «Тефонд», обладает радом очевидных и неоспоримых преимуществ:
Обеспечить высокие темпы производства работ (2000-3000 м²/смена)
Избежать затрат времени на устройство бетонной подготовки
Существенно снизить трудоемкость работ
Защитить от влаги фундаментную плиту
Даже, на первый взгляд, видны неоспоримые преимущества применения профилированных мембран ТЕФОНД
1. Высокая механическая прочность.
2. Водонепроницаемость – механический замок с герметиком и самоклеящаяся лента «ELOTENE» в местах поперечного нахлеста материала.
3. Быстрота и легкость укладки – не требуется специальное оборудование.
4. Снижение трудоемкости работ и обеспечение высоких темпов их производства.
5. Экономия времени и финансовых затрат на устройство бетонной подготовки.
Недолговечность наплавляемой битумной гидроизоляции, особенно в условиях агрессивного воздействия грунтовых вод, ультрафиолета либо механических воздействий, — известная для большинства строителей проблема. А потому вопрос защиты гидроизоляции фундамента и кровли — актуален. О современных методах и существующих материалах «Стройка» узнавала у специалистов.
Поговорить о новых материалах и способах их применения в рамках семинара «Проектирование и строительство подземных сооружений», прошедшего недавно в Минске, собрались одновременно несколько десятков профессионалов. Среди них — как непосредственно производители, так и представители крупнейших иностранных корпораций в Беларуси, руководители научных департаментов, технические консультанты.
Изготовители представили на семинаре относительно новые для белорусского строительного рынка технические решения озвученных задач. Речь о профилированных мембранах, ассортимент которых на рынке с каждым днем все шире: Тефонд, Planter, Изостуд, Delta, Вилладрейн — вот неполный перечень торговых марок, под которыми материалы производятся.
Что есть что
Профилированная мембрана представляет собой полотно из полиэтилена высокой плотности (ПВП) с отформованными на поверхности выступами (обычно сферическими или в форме усеченного конуса) высотой от 7 до 20 мм. Выпускается материал плотностью от 400 до 1000 г/м 2 и поставляется в рулонах шириной от 0,5 до 3,0 м, длиной 20 м.
Основные функции мембран — защита гидроизоляционных слоев и организация отвода воды. Воздушная прослойка, которая образуется между защищаемой поверхностью и мембраной за счет профилированных выступов на поверхности мембраны, обеспечивает дренирующее действие и защиту гидроизоляции фундамента, предотвращает образование и выпадение конденсата внутри изолируемых помещений.
Мембраны могут укладываться как вертикально, так и горизонтально. Между собой они свариваются горячим воздухом, склеиваются специальной соединительной лентой или соединяются в замок.
Области применения
Основные задачи, для решения которых предназначены мембраны: замена бетонной подготовки, защита гидроизоляции фундаментов, обустройство дренажа фундамента или эксплуатируемой кровли, обустройство гидроизоляции тоннелей, метрополитена. Сопутствующие: устройство «стены в грунте», санация влажных стен снаружи и внутри помещения.
Замена бетонной подготовки
Бетонная подготовка — обязательный этап в строительстве любого здания, обычно осуществляемый посредством заливки по уплотненному грунту тощего бетона толщиной 100 мм. В том случае, если здание возводится на грунте с низким уровнем грунтовых вод и в условиях отсутствия подпора воды, использование мембран является альтернативой бетонной подготовке.
Применение мембран позволяет сократить время проведения работ и снизить их себестоимость, защитить фундаментную плиту и увеличить срок службы системы.
Защита гидроизоляции фундаментов
Как отмечают строители, наибольшую опасность для гидроизоляции фундаментов представляет период нулевого цикла до выполнения обратной засыпки, поскольку гидроизоляционный слой не защищен от разрушительного воздействия ультрафиолета, но главное — механических воздействий. Велик также риск повреждения гидроизоляционного слоя строительным мусором, которым изобилует грунт обратной засыпки. В процессе эксплуатации гидроизоляция также может подвергаться агрессивному химическому воздействию грунтовых вод, что негативно скажется на сроке ее эксплуатации.
Среди существующих вариантов защиты — тяжелый и дорогой плоский шифер или кирпичная стена, обустройство которой является еще более трудоемким и дорогостоящим процессом.
Альтернативой разработчики называют мембраны, которые отличаются высокой скоростью и простотой проведения работ по устройству гидроизоляции фундамента и низкой стоимостью. Мембрана раскатывается выступами к фундаменту, образуя тем самым воздушный зазор между грунтом и гидроизоляцией. Локальные нагрузки, создаваемые грунтом, равномерно распределяются по всей площади, что позволяет избежать местных повреждений слоя гидроизоляции. Полиэтилен является химически стойким материалом и защищает гидроизоляцию от негативного воздействия агрессивных почв.
Локальные нагрузки, создаваемые грунтом, равномерно распределяются по всей площади, что позволяет избежать местных повреждений слоя гидроизоляции. Полиэтилен является химически стойким материалом и защищает гидроизоляцию от негативного воздействия агрессивных почв.
Системы гидроизоляции и дренажа фундамента и эксплуатируемой кровли
Одним из основных элементов системы гидроизоляции фундамента является дренаж, способствующий удалению воды от сооружения. В эксплуатируемой кровле дренажная прослойка выполняет схожую функцию, удаляя воду от кровельного пирога. В обоих случаях дренаж позволяет избежать давления воды на слой гидроизоляции и, как следствие, прорывов изоляции, проникновения воды и повреждения конструкции.
При гидроизоляции фундамента, мембраны применяют в роли вертикального пристенного дренажа — мембрана (рекомендуется использовать вариант с геотекстилем) фильтрует воду и быстро удаляет ее в дренажную трубу. При этом роль фильтрующего элемента, в качестве которого раньше использовался песок, выполняет геотекстиль мембраны. Поэтому от использования песка можно отказаться, сразу перейдя к обратной засыпке грунта.
Поэтому от использования песка можно отказаться, сразу перейдя к обратной засыпке грунта.
При обустройстве кровель мембрана с геотекстиелем укладывается под песчаную засыпку. Геотекстиль выполняет роль фильтрующего элемента, а сама мембрана — роль дренажной прослойки водопропускной способностью, значительно превосходящей возможный приток воды.
Профилированные мембраны используются и при гидроизоляции тоннелей
, где основная цель мембраны — не остановка или перекрытие грунтовых вод, а обеспечение их отвода естественным путем (вода стекает в дренаж по стенкам мембраны естественным путем под действием силы тяжести). Используют мембраны и при ведении работ методом «стена в грунте
», при котором мембраны позволяют решить довольно сложную задачу защиты котлована от проникновения грунтовых вод.
Производители, виды
Сегодня рынок профилированных мембран представлен несколькими именитыми производителями. Как правило, принципиального отличия в конструкции материала нет. Каждый производитель в линейке предлагаемых материалов имеет несколько марок мембран, различающихся наличием или отсутствием герметика в местах соединения, дополнительным слоем геотекстиля (тканое полипропиленовое полотно, нетканое покрытие из полиэстера), одинарным или двойным замком, перфорацией, дополнительным слоем полиэтилена.
Каждый производитель в линейке предлагаемых материалов имеет несколько марок мембран, различающихся наличием или отсутствием герметика в местах соединения, дополнительным слоем геотекстиля (тканое полипропиленовое полотно, нетканое покрытие из полиэстера), одинарным или двойным замком, перфорацией, дополнительным слоем полиэтилена.
|
Название |
Характеристика |
Область применения |
|
Профилированные мембраны |
||
|
Planter Standart |
||
|
Planter |
Двухслойная мембрана из ПВП и термоскрепленного геотекстиля; плотность 600 г/м 2 |
Организация пристенного дренажа; организация пластового дренажа в эксплуатируемых кровлях |
|
Planter |
Защита гидроизоляции; замена бетонной подготовки; санация влажных стен с внешней или внутренней стороны |
|
|
Planter |
Однослойное полотно из полиэтилена высокой плотности; плотность 800 г/м 2 |
Защита гидроизоляции; замена бетонной подготовки; строительство и реконструкция автомобильных дорог и откосов; выполнение работ в сложных грунтово-гидрологических условиях; строительство тоннелей и метрополитенов; обустройство дренажа при строительстве тоннелей закрытого типа; пластовый дренаж |
|
Профилированные мембраны Тефонд |
||
|
Тефонд |
Однослойное полотно из ПВП с одинарным механическим замком; плотность 600 г/м 2 |
Защита гидроизоляции; замена бетонной подготовки; гидроизоляция полов и межэтажных перекрытий; звукоизоляция |
|
Тефонд плюс |
Однослойное полотно из ПВП с двойным механическим замком и изоляционным швом; плотность 670 г/м 2 |
Защита гидроизоляции и гидроизоляция фундамента и стен, плоской кровли; защита фундаментной плиты; гидроизоляция каналов |
|
Тефонд Айч Пи |
Однослойное усиленное полотно из ПВП с герметичным швом; плотность 850 г/м 2 |
Стабилизация основания полотна дороги, гидроизоляция, укрепление грунта; обустройство дренажа; снижение механического воздействия на основание дороги; гидроизоляция, защита тоннелей |
|
Тефонд Дрейн |
Двухслойная мембрана из ПВП с механическим замком и нетканым полиэстером; плотность мембраны |
Защита гидроизоляции фундамента; организация пристенного дренажа |
|
Тефонд Дрейн Плюс |
Двухслойная мембрана из ПВП с двойным механическим замком, гидроизоляционным швом и геотекстилем из полипропилена; плотность мембраны 660 г/м 2 , полипропилена 100 г/м 2 |
Организация дренажа, защита от механического и химического воздействия, препятствие для корневых систем; защита гидроизоляции и гидроизоляция |
|
Профилированные мембраны Изостуд и |
||
|
Изостуд |
Однослойное полотно из ПВП; плотность 500 г/м 2 |
Защита гидроизоляции фундамента, отмостки, стен подвала, эксплуатируемой кровли; замена бетонной подготовки; стабилизация грунта при благоустройстве территории |
|
Изостуд МС |
Однослойное полотно из ПВП; плотность 400 г/м 2 |
Защита гидроизоляции фундамента, отмостки; благоустройство территории |
|
Изостуд Про |
Однослойное полотно из ПВП с технологическими припусками для герметизации швов; плотность 600 г/м 2 |
Защита гидроизоляции фундамента, отмостки, стен подвала, эксплуатируемой кровли; замена бетонной подготовки; благоустройство территории |
|
Изостуд Гео |
Двухслойная мембрана из ПВП и термоскрепленного геотекстиля; плотность 630 г/м 2 |
Защита гидроизоляции фундамента, стен подвала; организация пристенного дренежа; обустройство зеленой кровли; противокорневая защита |
|
Изостуд Пластер |
Двухслойная мембрана из ПВП и стеклосетки |
Организация пристенного дренажа; санация влажных стен |
|
Maxistud |
Однослойное полотно из ПВП |
Замена бетонной подготовки |
|
Maxistud |
Противокорневая защита; организация дренажа при обустройстве эксплуатируемой кровли |
|
|
Профилированные мембраны DELTA |
||
|
DELTA-MS / DELTA-NB |
Однослойное полотно из ПВП |
Защита гидроизоляции фундамента; замена бетонной подготовки; организация пристенного дренажа; организация пластового дренажа |
|
DELTA-MS-20 |
Однослойное полотно из ПВП |
Организация пластового дренажа в подземных сооружениях; обустройство «стены в грунте»; организация дренажа в тоннелях закрытого типа |
|
DELTA-PT |
Двухслойная мембрана из ПВП и полиэфирной сетки |
Санация влажных подвалов и стен изнутри; организация дренажа тоннелей |
|
DELTA DRAIN |
Двухслойная мембрана из ПВП с двусторонними выступами и геотекстиля (полипропилена) |
Организация пристенного дренажа; защита гидроизоляции фундамента; организация горизонтального дренажа при обустройстве зеленых крыш |
|
DELTA-NP DRAIN |
Защита гидроизоляции фундамента; организация пристенного дренажа; организация пластового дренажа |
|
|
DELTA-TERRAXX |
Двухслойная мембрана из ПВП и термоскрепленного геотекстиля (полипропилена) |
Защита гидроизоляции фундамента; организация дренажа; обустройство эксплуатируемых и зеленых крыш, подземных гаражей, «стены в грунте», террас, газонов |
|
DELTA-GEO-DRAIN Quattro |
Четырехслойная мембрана из ПВП, геотекстиля (полипропилена), полиэтилена в качестве скользящего слоя и полипропилена |
Защита гидроизоляции фундамента в сложных грунтах и при большой глубине заложения, в случаях осадки грунта обратной засыпки, при пучении грунта; организация пристенного дренажа |
|
DELTA-MS-20 с перфорацией |
Однослойное полотно из ПВП с перфорацией |
Обустройство эксплуатируемых и зеленых крыш |
|
Профилированные мембраны ВиллаДрейн |
||
|
ВиллаДрейн 8 |
Однослойное полотно из ПВП; плотность 500 г/м 2 ; высота выступа 8 мм |
|
|
ВиллаДрейн 20 |
Однослойное полотно из ПВП; плотность 1000 г/м 2 ; высота выступа 20 мм |
Защита гидроизоляции фундамента; организация пристенного и пластового дренажа; противокорневая защита; защита пола от капилярной влаги |
|
ВиллаДрейн 8 Гео |
Двухслойная мембрана из ПВП с геотекстилем; плотность мембраны 630 г/м 2 ; плотность геотекстиля 100 г/м 2 |
Защита гидроизоляции фундамента; организация пристенного и пластового дренажа; проивокорневая защита; защита пола от капилярной влаги |
Замена бетонной подготовки с применением профилированных мембран. January 29th, 2014
January 29th, 2014
Что мы представляем себе в воображении, когда слышим словосочетание «закладка фундамента»? Развороченную стройплощадку, заполненную оборудованием? Ревущие экскаваторы, буксующие самосвалы, работающие бульдозеры? Никто ведь не будет спорить о том, что надежный фундамент — это очень важно. А раз важно — значит, наверняка, чрезвычайно дорого, долго и непросто. Попробуем разобраться, так ли это.
Рассмотрев разные типы фундаментов, многие сегодня приходят к решению строить дом на монолитной фундаментной плите. Этот тип фундамента хорош тем, что его можно применять практически на любом грунте. Он обладает максимальной несущей способностью, при этом проще по трудозатратам. И ещё одно огромное преимущество — фундамент одновременно становится полом первого этажа, что существенно сокращает объем работ.
Традиционно под монолит с целью создания ровной поверхности и гидроизоляции заливали низкомарочный бетон — так называемую «бетонную подготовку». В настоящее время бетон заменяют профилированной мембраной
с выступами для механической защиты гидроизоляции, пластового дренажа в подземных и наземных сооружениях.
Профилированная мембрана обеспечивает надежное разделение стен фундамента и влажной земли. Выступы в форме усеченных конусов формируют вентиляционные каналы по всей поверхности стены, что позволяет выводить из неё избыточную влагу.
Использование профилированной мембраны для замены бетонной подготовки дает несомненные преимущества:
- .
Нет потерь рабочего времени на твердение бетона (от 1 до 3 суток в зависимости от толщины бетонной подготовки).
- .
Отсутствует необходимость в дополнительной выемке грунта и его вывозе.
- .
Не требуются строительное оборудование и автомашины (экскаваторы, самосвалы, бульдозеры).
- .
Высокая прочность мембраны на сжатие
- .
Дополнительная защита фундаментной плиты от воздействия грунтовой влаги (в случае проклейки нахлёстов мембран лентами или клеями).
- .
Надёжная защита фундамента от прорастания корней деревьев и растений.
- .
Защита от потери цементного молочка из раствора в грунт.

- .
Проще работать в холод и в жару — не требуется защита тощего бетона от растрескивания. Замену бетонной подготовки использованием дренажных мембран можно производить даже при отрицательной температуре окружающей среды и в дождливую погоду.
- ·
Плиту фундамента можно производить сразу же после раскладки мембранного полотна и укладки поверх него армирующего каркаса.
ИТОГ- Значительное снижение стоимости и времени монтажа квадратного метра основания
Порядок выполнения работ пo замене бетонной подготовки использованием дренажных мембран
Профилированные мембраны укладываются после нивелировки и утрамбования грунта (щебня).
- Рассчитать нужное количество материала, измерив ширину и длину площадки, и нарезать нужные куски материала.
- Уложить мембрану выступами вниз, с перехлестами на поперечных и продольных швах.
- Швы необходимо тщательно проклеить самоклеющимся материалом.
- Непосредственно на мембране укладывается арматура, которая фиксируется особым образом.
 Для связывания арматуры можно использовать пластиковые хомуты. Узлы, связывающие арматуру в монолитных конструкциях, не несут никакой нагрузки, соединения фиксируются только для того, чтобы придать форму на момент заливки бетоном.
Для связывания арматуры можно использовать пластиковые хомуты. Узлы, связывающие арматуру в монолитных конструкциях, не несут никакой нагрузки, соединения фиксируются только для того, чтобы придать форму на момент заливки бетоном.
Таким образом,половина работ по закладке фундамента уже выполнена.
Профилированные мембраны PLANTER — одно из самых современных решений для зданий и сооружений с повышенными требованиями к надежности и безопасности.
Технология подготовки основания для укладки монолитной фундаментной плиты с применением профилированных мембран PLANTER
получила широкое применение в современном строительстве.
Преимущества системы:
- Монтаж в 3 раза быстрее бетонной подготовки и не требует времени для набора прочности;
- Обеспечивает защиту от радона;
- Обеспечивает оптимальные условия для твердения бетона;
- Экономит в среднем 30% относительно традиционных решений;
- Регламентировано НИИЖБ и СНиП Полы.

Инновационная конструкция с профилированной мембраной PLANTER:
1.
Ж/Б плита фундамента;
2.
Профилированная мембрана PLANTER standard/extra
;
3.
Песчаная подготовка;
4.
Грунт основания;
5.
Лента самоклеящаяся PLANTERBAND
;
6.
Фиксатор для арматуры PLANTER Base
;
7.
Гидрошпонка EC-240-2.
Как выглядит классическая подготовка основания под фундамент?
Традиционная конструкция
Строительство фундамента неизбежно требует подготовки грунтового основания. На площадке с невысоким уровнем грунтовых вод она заключается в планировке поверхности, выемке грунта, подготовке дна котлована и создании капиллярной отсечки. Классическим способом подготовки дна котлована еще с конца ХХ века считается подготовка из бетона толщиной от 80 до 100 мм – так называемая «подбетонка». Выполняют «подбетонку» для наплавления оклеечной гидроизоляции, а также для получения ровной и прочной поверхности перед установкой арматуры. Классическая «подбетонка» — это общеизвестная технология, но с низкой технологичностью.
Классическая «подбетонка» — это общеизвестная технология, но с низкой технологичностью.
В расчётах несущей способности фундамента «подбетонка» не участвует. При сооружении фундамента в песчаных грунтах с низким уровнем подземных вод прямой необходимости в защите плиты в виде гидроизоляции нет. Таким образом, целесообразно отказаться и от подбетонки для ее наплавления.
Технология укладки профилированной мембраны Planter standard
Как же выглядит современная подготовка основания под плитный фундамент?
Прекрасной альтернативой классической «подбетонке» являются профилированные мембраны PLANTER
. Подготовка основания под плитный фундамент из мембран имеет ряд технологических и экономических преимуществ.
Мембрана для фундамента ТехноНИКОЛЬ
Технологическая привлекательность применения мембран в качестве замены подбетонки заключается в способности мембран выполнять функции подбетонки, а именно:
- Получение ровной и твердой поверхности
, пригодной для ведения планировочных работ, работ по укладке арматурного каркаса и бетона; - Обеспечение оптимальных условий твердения бетона
(фундаментной плиты) и исключение миграции воды затворения и цементного теста из бетонной смеси в грунт основания.
Защитная мембрана для фундамента Planter
Помимо этого мембраны PLANTER
предотвращают капиллярное поднятие влаги, выполняя функцию капиллярной гидроизоляции под плитой фундамента. Технология применения мембран в качестве замены подбетонки одобрена специалистами Научно-исследовательского института бетона и железобетона (НИИЖБ) и апробирована на многих строительных объектах России и ближнего зарубежья.
просмотров
какие ошибки чаще встречаются » Вcероссийский отраслевой интернет-журнал «Строительство.RU»
Битумно-полимерные рулонные материалы серии ТЕХНОЭЛАСТ обеспечивают надежную защиту заглубленных сооружений различного назначения и степени ответственности. Известность технологии, высокое качество материалов, простота их укладки и отсутствие дорогостоящего оборудования – все это делает битумно-полимерные материалы самыми востребованными на рынке гидроизоляционных материалов. Тем не менее существует вероятность ошибок, которые могут привести к сбою гидроизоляционной мембраны.
По данным различных исследований можно выделить четыре основных типа ошибок:
- Ошибки проекта – 5-7%;
- Ошибки подбора материалов – 10-12%;
- Ошибки эксплуатации – 15-20%;
- Ошибки производства работ – 40-45%.
Ошибки проекта
Основные ошибки, возникающие при проектировании гидроизоляции строительных конструкций:
1. Отсутствие замкнутого контура гидроизоляции
Гидроизоляционная мембрана должна иметь замкнутый контур, чтобы эффективно защищать строительную конструкцию от негативного воздействия подземных вод. В проектах встречаются решения, в которых вертикальная гидроизоляционная мембрана идет с внешней стороны конструкции, а горизонтальная – с внутренней (рисунок 1).
Рис. 1 Незамкнутый контур гидроизоляционной мембраны
Такая конфигурация создает условия для проникновения подземных вод внутрь конструкции по технологическому шву. Помимо этого, горизонтальная гидроизоляционная мембрана из паронепроницаемых материалов создает барьер для движения паров воды, что приведет к образованию биологической коррозии под гидроизоляционным покрытием.
Биологическая коррозия под паронепроницаемым покрытием
К числу часто встречающихся ошибок можно отнести случай, когда фундаментную плиту выполняют из бетона с повышенным значением водонепроницаемости (W 10-14) без дополнительной защиты, а на вертикальные конструкции укладывают гидроизоляционную мембрану. Типовая ошибка в данном случае заключается в том, что вертикальную гидроизоляционную мембрану обрубают на верхней полке фундаментной плиты, что приводит к протечкам по технологическому шву сопряжения вертикальной и горизонтальной конструкций. Правильное решения в данном случае – завести гидроизоляционное покрытие на торец фундаментной плиты в максимально возможную нижнюю точку (рисунок 3). При этом, на всей поверхности фундаментной плиты гидроизоляционная мембрана должна быть полностью приплавлена к основанию, вне зависимости от способа ее крепления на остальной поверхности. О различных способах крепления гидроизоляционной мембраны из битумно-полимерных рулонных материалов, об их достоинствах и недостатках можно прочитать в других материалах сайта — в разделах «Материалы» и «Технология».
А) Нерекомендуемый вариант Б) Рекомендуемый вариант
Рис. 3 Стыковка гидроизоляционной мембраны с водонепроницаемым бетоном фундаментной плиты
Такая гидроизоляционная система (фундаментная плита с повышенной водонепроницаемостью без дополнительной защиты) подразумевает качественное выполнение бетонных работ. При невозможности обеспечить высокое качество их выполнения, рекомендуется предусматривать дополнительную защиту гидроизоляционными мембранами, т.к. затраты на их устройство будут невысокими, а потенциально возможные затраты по устранению протечек и восстановлению водонепроницаемости – очень высокими.
2. Незаведение гидроизоляционной мембраны выше уровня земли
Современное строительство подразумевает плотную городскую застройку, что стимулирует максимально возможную эксплуатацию подземного пространства. Это приводит к изменению гидрогеологической обстановки в районе, где идет такое подземное строительство: меняются уровни подземных вод, меняются плотности грунтов основания (что может привести к просадкам), увеличивается насыщение грунта водой из-за утечек из коммуникаций (по данным исследований потери составляют 15-20 процентов). В этих условиях некоторые старые нормы проектирования защиты подземных конструкций становятся неактуальными, в том числе и необязательность заведения гидроизоляционной мембраны выше уровня земли. Между тем, для надежной защиты строительных конструкций от негативного воздействия подземных вод и грунтов основания необходимо заводить гидроизоляционное покрытие выше уровня земли минимум на 300 мм.
В этих условиях некоторые старые нормы проектирования защиты подземных конструкций становятся неактуальными, в том числе и необязательность заведения гидроизоляционной мембраны выше уровня земли. Между тем, для надежной защиты строительных конструкций от негативного воздействия подземных вод и грунтов основания необходимо заводить гидроизоляционное покрытие выше уровня земли минимум на 300 мм.
Рис. 4 Гидроизоляция заглубленных конструкций фундамента, гидроизоляционная мембрана ТЕХНОЭЛАСТ ТЕРРА заведена выше уровня земли, ЖК «Огни», г. Москва
3. Выполнение гидроизоляционного покрытия из разных типов материалов
Для создания замкнутого контура гидроизоляционной мембраны не рекомендуется применять различные типы гидроизоляционных материалов на различных основах, с различными физико-механическими характеристиками. Во-первых, зачастую состыковать некоторые типы материалов не представляется возможным из-за химической несовместимости. Во-вторых, зачастую грамотное обустройство такого узла очень дорого и трудозатратно. В-третьих, в любом случае, такое соединение будет самым слабым звеном во всем гидроизоляционном покрытии.
В-третьих, в любом случае, такое соединение будет самым слабым звеном во всем гидроизоляционном покрытии.
Рис. 5 Попытка состыковать горизонтальную гидроизоляционную мембрану из плотной п\э пленки и вертикальную гидроизоляционную мембрану из битумно-полимерной мастики
Но если по каким-то причинам все-таки необходимо выполнить стыковку двух гидроизоляционных мембран, выполненных из различных типов гидроизоляционных материалов, то такую стыковку следует выполнять на рядовой поверхности, на которую не действуют высокие сжимающие или растягивающие усилия, и не рекомендуется выполнять в районе следующих узлов:
- Деформационных швов;
- Перехода с вертикальной на горизонтальную поверхность;
- Внутренних и внешних углов;
- Установки фундаментов под тяжелое оборудование;
- Примыкания к сваям.
4. Отсутствие праймера для наплавляемых материалов
Праймирование основания, при выполнении работ методом полного наплавления битумно-полимерных рулонных материалов, является обязательным этапом производства работ. Это позволяет обеспечить необходимую величину адгезионного сцепления гидроизоляционного материала с основанием, а также связать мелкие частицы пыли, которые негативно влияют на адгезию.
Это позволяет обеспечить необходимую величину адгезионного сцепления гидроизоляционного материала с основанием, а также связать мелкие частицы пыли, которые негативно влияют на адгезию.
5. Неверный узел перехода гидроизоляционного покрытия с горизонтальной поверхности на вертикальную
Одним из самых сложных узлов при устройстве гидроизоляционного покрытия является узел стыковки вертикальной и горизонтальной гидроизоляционных мембран. В настоящее время существует три способа обустройства такого узла:
- Стыковка на предварительно обустроенной рядом с фундаментом вертикальной стенке;
- Стыковка на вертикальной части фундаментной плиты;
- Стыковка на вынесенной за пределы фундамента бетонной подготовке.
Основываясь на практическом опыте, мы рекомендуем применять вариант стыковки гидроизоляционных мембран на бетонной подготовке. Для этого необходимо вынести бетонную подготовку на 300 мм за край фундаментной плиты.
Рис. 6 Рекомендуемый вариант стыковки горизонтальной и вертикальной гидроизоляционных мембран
6 Рекомендуемый вариант стыковки горизонтальной и вертикальной гидроизоляционных мембран
Если в районе строительства возможны просадки, что может привести к излому бетонной подготовки, то в этом случае рекомендуется выполнить ее армировку в зоне края фундаментной плиты. Армировку можно выполнить дорожной сеткой на 150 мм в каждую сторону от края фундаментной плиты.
Главными недостатками двух остальных вариантов являются:
- Невозможность обеспечить качественное сплавление рулонов битумно-полимерного материала;
- Частичное наплавление материалов стороной, непригодной для наплавления;
- Необходимость одновременно наплавлять гидроизоляционную мембрану на длинном отрезке (несколько десятком метров).
6. Отсутствие защитного покрытия
Одну из самых больших опасностей для гибкой гидроизоляционной мембраны представляет период от выполнения работ нулевого цикла до выполнения обратной засыпки пазух котлована, так как в этот период мембрана не защищена от воздействий: механических повреждений, собственного веса, ультрафиолетового излучения и т. д. При выполнении обратной засыпки грунтом очень велик риск повреждения гидроизоляционной мембраны механизмами, крупными (или смерзшимися) включениями, строительным мусором. При дальнейшей эксплуатации здания есть опасность осадки грунта обратной засыпки, прорастания корней деревьев сквозь гидроизоляцию, морозного пучения грунтов. Для предотвращения нежелательных процессов разрушения мембраны, ее необходимо защищать.
д. При выполнении обратной засыпки грунтом очень велик риск повреждения гидроизоляционной мембраны механизмами, крупными (или смерзшимися) включениями, строительным мусором. При дальнейшей эксплуатации здания есть опасность осадки грунта обратной засыпки, прорастания корней деревьев сквозь гидроизоляцию, морозного пучения грунтов. Для предотвращения нежелательных процессов разрушения мембраны, ее необходимо защищать.
Эффективным способом защиты является применение профилированных мембран PLANTER. Материалы PLANTER изготавливаются из полиэтилена высокой плотности с отформованными шипами высотой 8 мм.
Рис. 7 Применение профилированной мембраны PLANTER для защиты гидроизоляционной мембраны ТЕХНОЭЛАСТ ТЕРРА,
Бизнес-школа Сколково, г. Москва
Для защиты гидроизоляционного покрытия от механического повреждения также применяют теплоизоляционные плиты из экструзионного пенополистирола XPS CARBON.
Под термином «теплоизоляция» принято понимать проведение мероприятий по сокращению расходов на отопление сооружения при его эксплуатации, обеспечению требуемой и постоянной во времени температуры внутри помещения, предотвращению образования конденсата на внутренних поверхностях заглубленных сооружений. Установлено, что теплопотери сооружения через фундамент и ограждающие конструкции подземных частей составляют 10÷20 % от общего объема теплопотерь конструкции в целом. Кроме того, теплоизоляционная защита является составным элементом гидроизоляционной системы и предохраняет от разрушения и температурного старения гидроизоляционную мембрану.
Установлено, что теплопотери сооружения через фундамент и ограждающие конструкции подземных частей составляют 10÷20 % от общего объема теплопотерь конструкции в целом. Кроме того, теплоизоляционная защита является составным элементом гидроизоляционной системы и предохраняет от разрушения и температурного старения гидроизоляционную мембрану.
Применение плит из экструзионного пенополистирола XPS CARBON для теплоизоляции заглубленных сооружений приводит к снижению затрат на отопление, улучшаются условия работы конструкций, повышается комфортность помещений для персонала и т.д. Применение теплоизоляционного слоя также способствует продлению долговечности гидроизоляционных мембран.
Рис. 8 Утепление фундамента с применением плит экструзионного пенополистирола XPS CARBON, ЖК Кварталы, г. Москва
Приведенные выше способы значительно эффективней традиционных, которые являются очень материало- и трудоёмкими:
- Защита плоским шифером толщиной 8 м;
- Защита кирпичной стенкой толщиной в полкирпича;
- Защита монолитной бетонной тонкой стенкой, набетонкой.

Ошибки подбора материалов
- Применение материалов невысокого качества. Не рекомендуется применять материалы на окисленном битуме, или с недостаточным количеством полимермодификатора из-за невысокой долговечности таких материалов.
- Применение материалов с основой на стеклохолсте и стеклоткани. Материалы на данных основах резко ухудшают свои физико-механические характеристики даже при незначительной химической нагрузке.
Рис. 9 Испытание различных типов битумно-полимерных рулонных материалов, гибкость на брусе
Ошибки эксплуатации
Несмотря на то, что гидроизоляционная мембрана из битумно-полимерных рулонных материалов является надежной, и ошибки эксплуатации в большей степени относятся к покрытиям кровли, существует ряд ограничений и на фундаментах, несоблюдение которых может привести к ее повреждению:
- Необходимость защиты от ультрафиолета;
- Необходимость защиты от механического повреждения
Варианты защиты гидроизоляционной мембраны от механического повреждения мы рассматривали в рамках данной статьи чуть выше.
Необходимость защиты от ультрафиолета обусловлена тем, что битумно-полимерные рулонные материалы ТЕХНОЭЛАСТ ЭПП и ТЕХНОЭЛАСТ ТЕРРА не имеют защитой крупнозернистой посыпки, защищающей от негативного воздействия ультрафиолетовых лучей. Поэтому, не рекомендуется оставлять уложенный материал без дополнительной защиты на солнце более 14 дней.
Ошибки производства работ
Самый распространенный тип ошибок, на долю которого приходится более 40% отказов по гидроизоляции. Но об этом мы поговорим в следующей статье.
Андрей ЗУБЦОВ,
ведущий технический специалист Направления «Гидроизоляция Строительных Конструкций» Корпорации ТЕХНОНИКОЛЬ
теплоизоляционный пенопласт — заказать, цена в Иркутске
Особенности:
Профилированная мембрана (PLANTER) – это полотно из полиэтилена высокой плотности (HPDE) с отформованными округлыми выступами высотой 8 мм.
Поверхность плантера эффективно распределяет давление грунта по всей площади основания или фундамента зданий и сооружений. При этом исключается образование локальных (точечных) нагрузок.
Пространство между стеной и полотном плантера, образованное выступами, позволяет свободно циркулировать воздуху, улучшая температурно-влажностный режим помещения.
Плантер отличается высокой механической прочностью и стойкостью к воздействию химически агрессивных сред, не подвержен разрушительному воздействию плесени и бактерий, устойчив к прорастанию корней деревьев.
Плантер может быть уложен как горизонтально, так и вертикально. При необходимости можно сварить полотна между собой по специально предусмотренному плоскому краю.
Область применения:
Основная функция мембран PLANTER-standart eco- защита гидроизоляционного слоя фундаментов и фундаментальной плиты от капиллярной влаги в коттеджном и малоэтажном строительстве.
Защита гидроизоляции
- от внешних воздействий на период строительства и при обратной засыпке грунта;
- от прорастания корней деревьев;
- от воздействия химически агрессивной среды;
- от дождевой воды;
- от осадки грунта.

Замена бетонной подготовки
- позволяет избежать затрат времени на изготовление бетонной подготовки;
- снижает трудоемкость и стоимость работ;
- защищает фундаментную плиту от напора воды снизу.
Санация влажных стен с внешней стороны здания
- изолирует подвальную стену от влажного грунта;
- улучшает температурно-влажностный режим стены.
Санация влажных стен с внутренней стороны
- изолирует подвальное помещение от влажной стены;
- обеспечивает оптимальный температурно-влажностный режим помещения;
- обеспечивает удаление скапливающейся влаги со стен во внутренний дренаж.
Аксессуары для термопресса
— Мембранная опорная плита 45 см x 45 см для TC5, TC5 SMART и TC5 LITE от Secabo
Термопресс переносит текст, логотипы или изображения на различные материалы. Устройство работает как с давлением, так и с теплом для достижения долгосрочных результатов. Термопресс похож на большой утюг, но с большим давлением и более интенсивным нагревом. Термопрессы подходят для широкого спектра процессов переноса.
Термопресс похож на большой утюг, но с большим давлением и более интенсивным нагревом. Термопрессы подходят для широкого спектра процессов переноса.
отделка одежды флоком и флексом
мотивы из флока или флекса или декали можно перенести на одежду с помощью термопресса.Например. футболки могут быть украшены именами, номерами или логотипом клуба
сублимационный перенос:
В этом процессе термопресс переносит графику, фотографии и тексты, напечатанные на обычном принтере, на полиэфирные материалы. Для печати не требуется ничего, кроме специальных сублимационных чернил. Тепло, создаваемое термопрессом, заставляет чернила окрашивать полиэфирные материалы. Помимо одежды, эта процедура подходит и для индивидуального оформления чашек, пазлов, ковриков для мыши, посуды и многого другого.Обратите внимание, что эту процедуру следует использовать только на ярких, предпочтительно белых материалах, чтобы обеспечить реалистичную цветопередачу.
Струйный гибкий:
Рисунок вырезается из гибкой фольги для струйной печати, а затем переносится на предмет одежды с помощью термопресса. Изюминка: Обычные чернила из обычного принтера сохраняются специальными шариками лака внутри гибкой фольги для струйных принтеров в процессе переноса. Это облегчает производство прочной текстильной отделки фотографического качества простейшими средствами.Например, можно создать футболку футбольного болельщика с вымпелом страны, например, вымпел страны на футболке футбольного болельщика и т. д.
Изюминка: Обычные чернила из обычного принтера сохраняются специальными шариками лака внутри гибкой фольги для струйных принтеров в процессе переноса. Это облегчает производство прочной текстильной отделки фотографического качества простейшими средствами.Например, можно создать футболку футбольного болельщика с вымпелом страны, например, вымпел страны на футболке футбольного болельщика и т. д.
Хромобластный перенос:
Рисунок вырезается из гибкой фольги для струйной печати, а затем переносится на предмет одежды с помощью термопресса. Изюминка: Обычные чернила из обычного принтера сохраняются специальными шариками лака внутри гибкой фольги для струйных принтеров в процессе переноса. Это облегчает производство прочной текстильной отделки фотографического качества простейшими средствами.Например, можно создать футболку футбольного болельщика с вымпелом страны, например, вымпел страны на футболке футбольного болельщика и т. д.
Зачем мне термопресс?
Использование и возможности термопресса столь же разнообразны, как и различные существующие методы переноса. Термопрессы позволяют как профессионалам, так и амбициозным любителям воплотить в жизнь свои личные дизайнерские идеи, например:
Термопрессы позволяют как профессионалам, так и амбициозным любителям воплотить в жизнь свои личные дизайнерские идеи, например:
Креативный дизайн чашек и кружек
Индивидуальный дизайн ковриков для мыши
Обработка и дизайн одежды, такой как футболки, куртки или свитера, например, для групп, школ, рабочая одежда, дизайнерские коллекции
прочное украшение одежды с мотивами из флока или флекса — идеально подходит для спортивных клубов
Создание индивидуальной шляпы
Создание собственного дизайна полотенец и текстиля для ванной комнаты
Креативное оформление крупномасштабными фотомотивами на плитке для ванной или кухни
создайте свои индивидуальные сумки
Какой термопресс подходит для моих проектов?
При выборе подходящего термопресса ключевыми факторами являются форма принимающего материала и размер переносимых объектов.Складные прессы или поворотные прессы используются для отделки плоских материалов, таких как текстиль или плитка, с индивидуальным дизайном. Например, термопресс Secabo TC 2 — это надежный фальцевальный пресс начального уровня для небольших конструкций. Термопресс Secabo TC 5 подходит для больших конструкций. Существуют специальные прессы для кружек, которые идеально адаптируются к форме кружки, что позволяет создавать индивидуальную коллекцию кружек, например, термопресс Secabo TMUG.
Например, термопресс Secabo TC 2 — это надежный фальцевальный пресс начального уровня для небольших конструкций. Термопресс Secabo TC 5 подходит для больших конструкций. Существуют специальные прессы для кружек, которые идеально адаптируются к форме кружки, что позволяет создавать индивидуальную коллекцию кружек, например, термопресс Secabo TMUG.
Secabo Мембранная опорная пластина Secabo 45см x 45см для TC5-в наличии
Мембранная опорная плита Secabo 45 см x 45 см для TC5 Мембранная опорная плита Secabo 45 см x 45 см для TC5 Мембранные панели Secabo открывают множество новых возможностей для использования термопресса Secabo, особенно при транспортировке объектов с большими перепадами высоты и неровными участками.Многие старые и почти все новые модели трансферных прессов подходят для дооснащения пассивными пластинами с мембранным дном. Небольшой веерный шар, мембрана которого легко надувается. Таким образом, можно определить максимальную компенсационную величину мембраны для переноса. Контактное давление регулируется, как обычно, на трансферном прессе, например, колесиком на нагревательной плите. Манометр показывает в закрытом состоянии передаточного пресса текущее давление с точностью до граммов на квадратный сантиметр. В процессе прессования можно точно регулировать давление нагнетательного шара и сливного клапана.С мембранно-нижних пластин Secabo можно считывать не только фактическую трансферную печать, но и многократно воспроизводимо корректировать. Мембранные поддоны для рабочих поверхностей размером 38см х 38см и 40см х 50см. Мембранные пластины имеют четные размеры 45 см x 45 см x 57 см или 47 см. Они могут быть установлены непосредственно на основании многих термопрессов Secabo, а также известны благодаря системам быстрой замены и удлинителям направляющих от Secabo.
Контактное давление регулируется, как обычно, на трансферном прессе, например, колесиком на нагревательной плите. Манометр показывает в закрытом состоянии передаточного пресса текущее давление с точностью до граммов на квадратный сантиметр. В процессе прессования можно точно регулировать давление нагнетательного шара и сливного клапана.С мембранно-нижних пластин Secabo можно считывать не только фактическую трансферную печать, но и многократно воспроизводимо корректировать. Мембранные поддоны для рабочих поверхностей размером 38см х 38см и 40см х 50см. Мембранные пластины имеют четные размеры 45 см x 45 см x 57 см или 47 см. Они могут быть установлены непосредственно на основании многих термопрессов Secabo, а также известны благодаря системам быстрой замены и удлинителям направляющих от Secabo.
Мембранная опорная пластина Secabo 45 см x 45 см для TC5
полностью совместим с:
Secabo |TC5
MSS предоставляет все оригинальные детали для этого оборудования Secabo. Узнайте больше о запасных частях и печатающих головках Secabo, посетив наш Ресурсный центр, где вы найдете все запасные части для вашей машины и всех других моделей. Все наши запасные части поставляются из США, и в зависимости от вашего местонахождения мы найдем ближайший и отправим его с любого из наших объектов по всей территории Соединенных Штатов. Также, пожалуйста, обратитесь к нам за нашей службой технической поддержки, доступной удаленно и по предварительной записи через нашу сеть технических специалистов по всему миру.
Узнайте больше о запасных частях и печатающих головках Secabo, посетив наш Ресурсный центр, где вы найдете все запасные части для вашей машины и всех других моделей. Все наши запасные части поставляются из США, и в зависимости от вашего местонахождения мы найдем ближайший и отправим его с любого из наших объектов по всей территории Соединенных Штатов. Также, пожалуйста, обратитесь к нам за нашей службой технической поддержки, доступной удаленно и по предварительной записи через нашу сеть технических специалистов по всему миру.
Для получения дополнительной информации о характеристиках вашего оборудования вы также можете получить дополнительную информацию о вашем оборудовании HP¬† через нашу сеть производителей
Базальная мембрана – обзор
Базальная мембрана и наружная пластинка
Базальная мембрана и наружная пластинка представляют собой специализированные листы внеклеточного матрикса, которые лежат между паренхиматозными клетками и поддерживающими тканями белки внеклеточного матрикса и ГАГ, а также действуют как интерфейс между паренхиматозными клетками и поддерживающими тканями.
Они связаны с эпителиальными клетками, мышечными клетками и шванновскими клетками, а также образуют ограничивающую мембрану вокруг центральной нервной системы. Базальная мембрана и наружная пластинка имеют сходное строение.
Базальные мембраны состоят из пяти основных компонентов: коллагена IV типа (рис. 4.11), ламинина, гепарансульфата, энтактина и фибронектина. За исключением фибронектина, они синтезируются паренхиматозными клетками. Кроме того, имеется множество второстепенных и плохо охарактеризованных белковых и ГАГ-компонентов.
Общая структура базальной мембраны хорошо охарактеризована (рис. 4.12). На это накладываются минорные белковые и углеводные компоненты, специфичные для определенных тканей. Так, например, базальная мембрана почек отличается от таковой кожи.
Основными функциями базальной мембраны являются клеточная адгезия, диффузионный барьер и регуляция роста клеток
Базальная мембрана выполняет три основные функции: механизмы адгезии, чтобы закрепить их на базальной мембране, тогда как базальная мембрана прочно прикреплена к внеклеточному матриксу опорных тканей, особенно к коллагену. Если такой интерфейс встречается в неэпителиальных тканях, например, вокруг мышечных клеток, он называется внешней пластинкой .
Если такой интерфейс встречается в неэпителиальных тканях, например, вокруг мышечных клеток, он называется внешней пластинкой .
Во-вторых, базальная мембрана действует как молекулярное сито (барьер проницаемости), размер пор которого зависит от заряда и пространственного расположения входящего в ее состав ГАГ. Таким образом, базальная мембрана кровеносных сосудов предотвращает утечку крупных белков в ткани, мембрана почек предотвращает потерю белка из отфильтрованной крови при выработке мочи, а мембрана легких обеспечивает диффузию газов.
В-третьих, базальная мембрана, вероятно, контролирует клеточную организацию и дифференцировку путем взаимного взаимодействия рецепторов клеточной поверхности и молекул внеклеточного матрикса. Эти взаимодействия являются предметом интенсивных исследований, особенно в изучении механизмов, которые могут предотвратить распространение и пролиферацию раковых клеток по всему телу.
Фагоподобная базовая пластина секрета типа VI TssEFGK-VgrG рекрутируется в мембранный комплекс TssJLM посредством множественных контактов и служит сборочной платформой для полимеризации хвостовой трубки/оболочки
Abstract
Система секреции типа VI (T6SS) представляет собой широко распространенное оружие, предназначенное для доставки белков-токсинов в эукариотические и прокариотические клетки. 13 субъединиц T6SS образуют цитоплазматическую сократительную структуру, прикрепленную к клеточной оболочке с помощью трансмембранного комплекса. Эта структура эволюционно, структурно и функционально связана с хвостом сократительных бактериофагов. У бактериофагов хвост соединяется с белковым комплексом, называемым базовой пластинкой, которая не только служит платформой во время сборки трубки и оболочки, но и запускает сокращение оболочки. Хотя был достигнут прогресс в понимании сборки и функционирования T6SS, состав базовой пластины T6SS остается в основном неизвестным.Здесь мы сообщаем, что шесть белков T6SS — TssA, TssE, TssF, TssG, TssK и VgrG — необходимы для правильной сборки хвостовой трубки T6SS, и комплекс между VgrG, TssE, -F и -G может быть выделен. Кроме того, мы демонстрируем, что TssF и TssG имеют ограниченную гомологию последовательностей с известными компонентами фага, и мы сообщаем о сети взаимодействия между этими субъединицами и другими компонентами базовой пластинки и хвоста.
13 субъединиц T6SS образуют цитоплазматическую сократительную структуру, прикрепленную к клеточной оболочке с помощью трансмембранного комплекса. Эта структура эволюционно, структурно и функционально связана с хвостом сократительных бактериофагов. У бактериофагов хвост соединяется с белковым комплексом, называемым базовой пластинкой, которая не только служит платформой во время сборки трубки и оболочки, но и запускает сокращение оболочки. Хотя был достигнут прогресс в понимании сборки и функционирования T6SS, состав базовой пластины T6SS остается в основном неизвестным.Здесь мы сообщаем, что шесть белков T6SS — TssA, TssE, TssF, TssG, TssK и VgrG — необходимы для правильной сборки хвостовой трубки T6SS, и комплекс между VgrG, TssE, -F и -G может быть выделен. Кроме того, мы демонстрируем, что TssF и TssG имеют ограниченную гомологию последовательностей с известными компонентами фага, и мы сообщаем о сети взаимодействия между этими субъединицами и другими компонентами базовой пластинки и хвоста. В согласии с тем, что базовая пластинка является сборочной платформой для хвоста, анализы флуоресцентной микроскопии функциональных слитых белков GFP-TssF и TssK-GFP показывают, что эти белки собирают стабильные и статические кластеры, на которых полимеризуется оболочка.Наконец, мы показываем, что рекрутирование базовой пластины в аппарат требует начального позиционирования мембранного комплекса и контактов между TssG и белком TssM внутренней мембраны.
В согласии с тем, что базовая пластинка является сборочной платформой для хвоста, анализы флуоресцентной микроскопии функциональных слитых белков GFP-TssF и TssK-GFP показывают, что эти белки собирают стабильные и статические кластеры, на которых полимеризуется оболочка.Наконец, мы показываем, что рекрутирование базовой пластины в аппарат требует начального позиционирования мембранного комплекса и контактов между TssG и белком TssM внутренней мембраны.
Резюме автора
В окружающей среде бактерии конкурируют за привилегированный доступ к питательным веществам или к определенной нише. Поэтому бактерии разработали механизмы для устранения конкурентов. Среди них система секреции типа VI (T6SS) представляет собой сократительную машину, функционально сравнимую с арбалетом: внутренняя трубка обернута сократительной структурой.При сокращении этой внешней оболочки внутренняя трубка продвигается к клетке-мишени и доставляет антибактериальные эффекторы. Трубчатая структура собирается на белковом комплексе, называемом базовой пластиной. Здесь мы определяем состав базовой пластины, демонстрируя, что она состоит из пяти субъединиц: TssE, TssF, TssG, TssK и VgrG. Далее мы детализируем роль белков TssF и TssG, определяя их локализацию и идентифицируя их партнеров. Мы показываем, что в дополнение к TssE и VgrG, которые, как было показано, имеют гомологию с белками gp25 и gp27-gp5 бактериофага, белки TssF и TssG также имеют гомологию с компонентами бактериофага.Наконец, мы показываем, что эта базовая пластинка рекрутируется в мембранный комплекс TssJLM перед сборкой сократительной структуры хвоста. Это исследование позволяет лучше понять ранние события пути сборки этого молекулярного оружия.
Здесь мы определяем состав базовой пластины, демонстрируя, что она состоит из пяти субъединиц: TssE, TssF, TssG, TssK и VgrG. Далее мы детализируем роль белков TssF и TssG, определяя их локализацию и идентифицируя их партнеров. Мы показываем, что в дополнение к TssE и VgrG, которые, как было показано, имеют гомологию с белками gp25 и gp27-gp5 бактериофага, белки TssF и TssG также имеют гомологию с компонентами бактериофага.Наконец, мы показываем, что эта базовая пластинка рекрутируется в мембранный комплекс TssJLM перед сборкой сократительной структуры хвоста. Это исследование позволяет лучше понять ранние события пути сборки этого молекулярного оружия.
Образец цитирования: Brunet YR, Zoued A, Boyer F, Douzi B, Cascales E (2015) Фагоподобная базовая пластина секрета типа VI TssEFGK-VgrG рекрутируется в мембранный комплекс TssJLM посредством множественных контактов и служит сборочной платформой для хвоста Полимеризация трубки/оболочки.PLoS Genet 11(10):
е1005545.
https://doi.org/10.1371/journal.pgen.1005545
Редактор: Патрик Х. Виолье, Медицинская школа Женевского университета, ШВЕЙЦАРИЯ
Получено: 9 января 2015 г.; Принято: 30 августа 2015 г.; Опубликовано: 13 октября 2015 г.
Copyright: © 2015 Brunet et al. Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Доступность данных: Все соответствующие данные находятся в пределах документ и его вспомогательные информационные файлы.
Финансирование: Работа выполнена при поддержке Национального центра научных исследований, Университета Экс-Марсель и грантов Национального агентства исследований (ANR-10-JCJC-1303-03 и ANR-14-CE14- 0006-02) в ЕС. YRB и AZ получили докторские стипендии от Министерства исследований Франции. AZ был поддержан стипендией Fondation pour la Recherche Médicale (FDT20140931060). Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
YRB и AZ получили докторские стипендии от Министерства исследований Франции. AZ был поддержан стипендией Fondation pour la Recherche Médicale (FDT20140931060). Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
В окружающей среде бактерии ведут интенсивную войну. Бактерии сотрудничают или конкурируют за получение питательных веществ или за эффективную колонизацию ниши. Результат межбактериальных взаимодействий зависит от нескольких механизмов, включая кооперативное поведение или антагонистическую активность [1]. Недавно идентифицированная система секреции типа VI (T6SS) широко распространена среди протеобактерий и, как сообщается, играет ключевую роль в антагонизме между бактериальными сообществами [2-4].Хотя было показано, что для полной вирулентности по отношению к различным эукариотическим клеткам требуется несколько T6SS, большинство T6SS формируют бактериальные сообщества посредством межбактериальных взаимодействий [1]. В обоих случаях T6SS вводят токсичные эффекторы в клетки-мишени/реципиенты. Недавно был идентифицирован ряд антибактериальных токсинов, обладающих разнообразным репертуаром цитотоксической активности, таких как гидролазы пептидогликана, фосфолипазы или ДНКазы [1,5,6]. Доставка этих токсинов в периплазму или цитоплазму клетки-мишени приводит к быстрому лизису, который обычно происходит в течение нескольких минут [7-9].
В обоих случаях T6SS вводят токсичные эффекторы в клетки-мишени/реципиенты. Недавно был идентифицирован ряд антибактериальных токсинов, обладающих разнообразным репертуаром цитотоксической активности, таких как гидролазы пептидогликана, фосфолипазы или ДНКазы [1,5,6]. Доставка этих токсинов в периплазму или цитоплазму клетки-мишени приводит к быстрому лизису, который обычно происходит в течение нескольких минут [7-9].
На молекулярном уровне основной аппарат T6SS состоит из 13 консервативных субъединиц, которые образуют длинную цитоплазматическую трубчатую структуру, связанную с клеточной оболочкой транс-оболочечным комплексом [3,10-12]. Состав, структура и биогенез мембраносвязанного комплекса в последние годы хорошо охарактеризованы. Он состоит из трех белков: TssL, TssM и TssJ. Белки TssL и TssM взаимодействуют во внутренней мембране, тогда как периплазматический домен TssM контактирует с липопротеином внешней мембраны TssJ [13–15].Текущая модель считает цитозольный комплекс T6SS похожим на хвосты сократительных бактериофагов. Эти две родственные структуры имеют шприц для пункции клеток и сократительную оболочку, обертывающую внутреннюю трубку. Внутренняя трубка T6SS состоит из гексамеров ГПУ, уложенных друг на друга [16–18]. Шприц для прокалывания клеток собирается из тримера белка VgrG, на конце которого находится белок PAAR, и считается, что он закрывает трубку Hcp [16,19]. Эта структура структурно сравнима с хвостовой трубкой, состоящей из полимеризованных белков gp19, закрытых комплексом gp27-gp5, или концентратором, у бактериофага T4 [20].Белки TssB и TssC имеют структурное и функциональное сходство с оболочкой gp18 бактериофага T4 [8, 21–25]. Действительно, эксперименты с замедленной флуоресцентной микроскопией с использованием слияния TssB-GFP показали, что эти структуры очень динамичны: они собирают трубки микрометровой длины, которые последовательно расширяются за десятки секунд и сокращаются за несколько миллисекунд [8,9,26,27]. . Считается, что механизм сокращения аналогичен механизму сократительных бактериофагов [22–25].
Эти две родственные структуры имеют шприц для пункции клеток и сократительную оболочку, обертывающую внутреннюю трубку. Внутренняя трубка T6SS состоит из гексамеров ГПУ, уложенных друг на друга [16–18]. Шприц для прокалывания клеток собирается из тримера белка VgrG, на конце которого находится белок PAAR, и считается, что он закрывает трубку Hcp [16,19]. Эта структура структурно сравнима с хвостовой трубкой, состоящей из полимеризованных белков gp19, закрытых комплексом gp27-gp5, или концентратором, у бактериофага T4 [20].Белки TssB и TssC имеют структурное и функциональное сходство с оболочкой gp18 бактериофага T4 [8, 21–25]. Действительно, эксперименты с замедленной флуоресцентной микроскопией с использованием слияния TssB-GFP показали, что эти структуры очень динамичны: они собирают трубки микрометровой длины, которые последовательно расширяются за десятки секунд и сокращаются за несколько миллисекунд [8,9,26,27]. . Считается, что механизм сокращения аналогичен механизму сократительных бактериофагов [22–25]. Недавние анализы флуоресцентной микроскопии в смешанной культуре показали, что сокращение этой оболочечной структуры коррелирует с умерщвлением добычи [7-9].Основываясь на этих данных и на механизме заражения бактериофагами, современная модель предполагает, что сокращение оболочечной структуры продвигает внутреннюю трубку Hcp к клетке-мишени, что приводит к прокалыванию клеточной оболочки и доставке антибактериальных токсинов [3, 10,28]. У хвостатых фагов трубка и оболочка полимеризуются в структуре, называемой базовой пластинкой. Базальная пластинка бактериофага Т4 состоит из 140 полипептидных цепей не менее 16 различных белков. Эта очень сложная конструкция собирается из 6 клиньев, окружающих центральную ступицу.Семь белков образуют клинья базовой пластины (gp11, gp10, gp7, gp8, gp6, gp53 и gp25) [22,29-31]. Однако у других хвостатых бактериофагов, таких как P2, базальная пластинка значительно менее сложна, поскольку состоит только из четырех различных субъединиц: gpV (гомолог хаба) и клиновидных компонентов W (гомолог gp25), gpJ (gp6- подобное) и gpI [32,33].
Недавние анализы флуоресцентной микроскопии в смешанной культуре показали, что сокращение этой оболочечной структуры коррелирует с умерщвлением добычи [7-9].Основываясь на этих данных и на механизме заражения бактериофагами, современная модель предполагает, что сокращение оболочечной структуры продвигает внутреннюю трубку Hcp к клетке-мишени, что приводит к прокалыванию клеточной оболочки и доставке антибактериальных токсинов [3, 10,28]. У хвостатых фагов трубка и оболочка полимеризуются в структуре, называемой базовой пластинкой. Базальная пластинка бактериофага Т4 состоит из 140 полипептидных цепей не менее 16 различных белков. Эта очень сложная конструкция собирается из 6 клиньев, окружающих центральную ступицу.Семь белков образуют клинья базовой пластины (gp11, gp10, gp7, gp8, gp6, gp53 и gp25) [22,29-31]. Однако у других хвостатых бактериофагов, таких как P2, базальная пластинка значительно менее сложна, поскольку состоит только из четырех различных субъединиц: gpV (гомолог хаба) и клиновидных компонентов W (гомолог gp25), gpJ (gp6- подобное) и gpI [32,33]. Основываясь на этом наблюдении, Leiman & Shneider сформулировали концепцию минимальной сократительной хвостоподобной структуры [22]. В минимальном сократительном хвосте базовая пластина может быть значительно «упрощена», пока она выполняет свои основные функции: контроль сборки трубки, инициирование полимеризации оболочки и запуск сокращения оболочки.Тогда минимальная базовая пластина должна сохранять центральный узел и три других клиновидных белка: gp6, gp25 и gp53 [22]. Центральная втулка несет шип и действует как переходник с тройного на шестигранный, соединяющий хвостовую трубу. Gp25 инициирует полимеризацию оболочки. Gp6 соединяет клинья вместе, сохраняя целостность базовой пластины в процессе инфицирования. Роль gp53 остается неясной. Однако gp53 необходим для сборки gp25 на кольце gp6 [22]. В T6SS для сборки хвостовой трубы и оболочки должны использоваться компоненты, выполняющие аналогичные функции.За исключением TssE и VgrG, которые имеют поразительную гомологию с белком gp25 и комплексом gp27-gp5 hub соответственно, компоненты, которые собирают базовую пластинку T6SS, неизвестны.
Основываясь на этом наблюдении, Leiman & Shneider сформулировали концепцию минимальной сократительной хвостоподобной структуры [22]. В минимальном сократительном хвосте базовая пластина может быть значительно «упрощена», пока она выполняет свои основные функции: контроль сборки трубки, инициирование полимеризации оболочки и запуск сокращения оболочки.Тогда минимальная базовая пластина должна сохранять центральный узел и три других клиновидных белка: gp6, gp25 и gp53 [22]. Центральная втулка несет шип и действует как переходник с тройного на шестигранный, соединяющий хвостовую трубу. Gp25 инициирует полимеризацию оболочки. Gp6 соединяет клинья вместе, сохраняя целостность базовой пластины в процессе инфицирования. Роль gp53 остается неясной. Однако gp53 необходим для сборки gp25 на кольце gp6 [22]. В T6SS для сборки хвостовой трубы и оболочки должны использоваться компоненты, выполняющие аналогичные функции.За исключением TssE и VgrG, которые имеют поразительную гомологию с белком gp25 и комплексом gp27-gp5 hub соответственно, компоненты, которые собирают базовую пластинку T6SS, неизвестны. По аналогии с путем морфогенеза сократительных бактериофагов мы предположили, что сборка хвостовой трубки должна быть нарушена при отсутствии функциональной базальной пластинки. Поэтому недавно мы разработали биохимический подход, основанный на межмолекулярных дисульфидных связях, для исследования сборки Hcp трубки in vivo в цитоплазме энтероагрегативной Escherichia coli (EAEC) [18].Мы продемонстрировали, что гексамеры Hcp укладываются «голова к хвосту» с образованием добросовестных трубчатых структур in vivo [18]. Что еще более важно, точная организация стопки гексамеров Hcp стала неконтролируемой в отсутствие других компонентов T6SS. Здесь, используя коллекцию делеций неполярного гена T6SS, мы приводим доказательства того, что шесть белков T6SS необходимы для правильной сборки трубок Hcp: TssA, TssE, TssF, TssG, TssK и VgrG. Идентификация TssE и VgrG, двух известных гомологов компонентов базовой пластинки бактериофага, подтверждает экспериментальный подход.
По аналогии с путем морфогенеза сократительных бактериофагов мы предположили, что сборка хвостовой трубки должна быть нарушена при отсутствии функциональной базальной пластинки. Поэтому недавно мы разработали биохимический подход, основанный на межмолекулярных дисульфидных связях, для исследования сборки Hcp трубки in vivo в цитоплазме энтероагрегативной Escherichia coli (EAEC) [18].Мы продемонстрировали, что гексамеры Hcp укладываются «голова к хвосту» с образованием добросовестных трубчатых структур in vivo [18]. Что еще более важно, точная организация стопки гексамеров Hcp стала неконтролируемой в отсутствие других компонентов T6SS. Здесь, используя коллекцию делеций неполярного гена T6SS, мы приводим доказательства того, что шесть белков T6SS необходимы для правильной сборки трубок Hcp: TssA, TssE, TssF, TssG, TssK и VgrG. Идентификация TssE и VgrG, двух известных гомологов компонентов базовой пластинки бактериофага, подтверждает экспериментальный подход. Далее мы охарактеризуем белки TssF и TssG. Мы сообщаем, что эти два белка взаимодействуют и стабилизируют друг друга и вступают в контакт с TssE, TssK и VgrG, а также с компонентами трубки и оболочки. Биоинформатический анализ предполагает, что TssF и TssG имеют сходство с белками J и I базовой пластинки бактериофага P2 соответственно. Эксперименты с флуоресцентной микроскопией также показывают, что функциональные белки GFP-TssF ( sfGFP TssF) и TssK-GFP (TssK sfGFP ) собираются в статические фокусы вблизи клеточной оболочки.Целостность фокусов sfGFP TssF зависит от TssK, и его правильная локализация требует взаимодействия между TssF, TssG и цитоплазматической петлей TssM. Более того, эксперименты по совместной локализации с mCherry-меченым TssB демонстрируют, что кластеры sfGFP TssF располагаются до рекрутирования субъединиц оболочки и остаются в основании оболочки во время растяжения и сжатия. Взятые вместе биохимические и цитологические подходы, представленные в этом исследовании, подтверждают роль TssE, TssF, TssG, TssK и VgrG в качестве компонентов базовой пластинки T6SS и последовательной иерархии рекрутирования (мембранный комплекс, базальная пластинка, хвостовая трубка/оболочка) во время биогенеза T6SS.
Далее мы охарактеризуем белки TssF и TssG. Мы сообщаем, что эти два белка взаимодействуют и стабилизируют друг друга и вступают в контакт с TssE, TssK и VgrG, а также с компонентами трубки и оболочки. Биоинформатический анализ предполагает, что TssF и TssG имеют сходство с белками J и I базовой пластинки бактериофага P2 соответственно. Эксперименты с флуоресцентной микроскопией также показывают, что функциональные белки GFP-TssF ( sfGFP TssF) и TssK-GFP (TssK sfGFP ) собираются в статические фокусы вблизи клеточной оболочки.Целостность фокусов sfGFP TssF зависит от TssK, и его правильная локализация требует взаимодействия между TssF, TssG и цитоплазматической петлей TssM. Более того, эксперименты по совместной локализации с mCherry-меченым TssB демонстрируют, что кластеры sfGFP TssF располагаются до рекрутирования субъединиц оболочки и остаются в основании оболочки во время растяжения и сжатия. Взятые вместе биохимические и цитологические подходы, представленные в этом исследовании, подтверждают роль TssE, TssF, TssG, TssK и VgrG в качестве компонентов базовой пластинки T6SS и последовательной иерархии рекрутирования (мембранный комплекс, базальная пластинка, хвостовая трубка/оболочка) во время биогенеза T6SS. .
.
Результаты
ЦсА, ЦсЭ, ЦсФ, ЦсГ, ЦсК и ВгрГ необходимы для правильной сборки трубы ГПУ
Используя подход межмолекулярного сшивания in vivo , основанный на образовании дисульфидных связей между соседними цистеиновыми остатками, мы недавно сообщили, что гексамеры EAEC Hcp организуются «голова к хвосту» с образованием трубчатых структур в цитоплазме EAEC. Важно отметить, что мы также продемонстрировали, что эти гексамеры укладываются случайным образом в штамме, в котором отсутствуют субъединицы Sci-1 T6SS, что приводит к конфигурациям «голова к хвосту», «хвост к хвосту» и «голова к голове» ([18], рис. 1A).Во время морфогенеза хвостатых бактериофагов структуры хвостовой трубки и оболочки полимеризуются на сборочной платформе, называемой базовой пластиной [22]. Кроме того, хвостовая трубка gp19 бактериофага T4 не полимеризуется в отсутствие полностью функциональной базовой пластинки [34]. По аналогии мы пришли к выводу, что аберрантная сборка гексамеров Hcp in vivo может сообщать о дефектной структуре, подобной базовой пластинке, в T6SS. Поэтому мы исследовали сборку Hcp в каждом неполярном штамме Δ tss (каждый из которых лишен существенной субъединицы Tss) с использованием анализа дисульфидной связи.В качестве доказательства концепции мы ранее показали, что шиповидный белок Sci-1 T6SS, VgrG, необходим для правильной сборки трубочек Hcp [18]. Помимо белка Hcp C38S без цистеина, были протестированы три комбинации для исследования укладки «голова к хвосту» (G96C-S158C), «хвост к хвосту» (Q24C-A95C) или «голова к голове» (G48C). Как сообщалось ранее, анализ SDS-PAGE цитоплазматических экстрактов из окисленных клеток Δ hcp , продуцирующих эти варианты, показал, что комбинация G96C-S158C «голова-хвост» приводит к образованию димеров и комплексов с более высокой молекулярной массой, в то время как комбинация «хвост-хвост» Комбинации Q24C-A95C и прямые комбинации G48C остаются строго мономерными (рис. 1А).Аналогичные результаты были получены для фонов tssB , tssC и clpV , что свидетельствует о том, что компоненты хвостовой оболочки не регулируют сборку хвостовой трубы (рис.
Поэтому мы исследовали сборку Hcp в каждом неполярном штамме Δ tss (каждый из которых лишен существенной субъединицы Tss) с использованием анализа дисульфидной связи.В качестве доказательства концепции мы ранее показали, что шиповидный белок Sci-1 T6SS, VgrG, необходим для правильной сборки трубочек Hcp [18]. Помимо белка Hcp C38S без цистеина, были протестированы три комбинации для исследования укладки «голова к хвосту» (G96C-S158C), «хвост к хвосту» (Q24C-A95C) или «голова к голове» (G48C). Как сообщалось ранее, анализ SDS-PAGE цитоплазматических экстрактов из окисленных клеток Δ hcp , продуцирующих эти варианты, показал, что комбинация G96C-S158C «голова-хвост» приводит к образованию димеров и комплексов с более высокой молекулярной массой, в то время как комбинация «хвост-хвост» Комбинации Q24C-A95C и прямые комбинации G48C остаются строго мономерными (рис. 1А).Аналогичные результаты были получены для фонов tssB , tssC и clpV , что свидетельствует о том, что компоненты хвостовой оболочки не регулируют сборку хвостовой трубы (рис. 1В). Это согласуется с путем морфогенеза сократительных бактериофагов, у которых полимеризация хвостовой трубки непосредственно предшествует полимеризации оболочки. Важно отметить, что мы также наблюдали, что гексамеры Hcp должным образом собираются в цитоплазме мутантов tssJ , tssL и tssM (Fig. 1B).TssJ, TssL и TssM взаимодействуют с образованием транс-оболочечного комплекса, который закрепляет хвостоподобную структуру T6SS на мембранах [12-15]. Таким образом, правильная сборка структуры хвостовой трубки не зависит от мембранного комплекса, что согласуется с различной эволюционной историей мембранных и фаговых комплексов T6SS [2,35-37]. Однако контролируемая сборка трубок Hcp была нарушена в vgrG , tssA , tssE , tssF , tssG и tssK , взаимодействующих голова-к-хвосту в гексамерах Hcp. — хвостовая или головная упаковка (рис. 1В).Надлежащая сборка Hcp была восстановлена в этих различных мутантных штаммах, когда аллель дикого типа отсутствующего гена экспрессировалась из комплементарных векторов (рис.
1В). Это согласуется с путем морфогенеза сократительных бактериофагов, у которых полимеризация хвостовой трубки непосредственно предшествует полимеризации оболочки. Важно отметить, что мы также наблюдали, что гексамеры Hcp должным образом собираются в цитоплазме мутантов tssJ , tssL и tssM (Fig. 1B).TssJ, TssL и TssM взаимодействуют с образованием транс-оболочечного комплекса, который закрепляет хвостоподобную структуру T6SS на мембранах [12-15]. Таким образом, правильная сборка структуры хвостовой трубки не зависит от мембранного комплекса, что согласуется с различной эволюционной историей мембранных и фаговых комплексов T6SS [2,35-37]. Однако контролируемая сборка трубок Hcp была нарушена в vgrG , tssA , tssE , tssF , tssG и tssK , взаимодействующих голова-к-хвосту в гексамерах Hcp. — хвостовая или головная упаковка (рис. 1В).Надлежащая сборка Hcp была восстановлена в этих различных мутантных штаммах, когда аллель дикого типа отсутствующего гена экспрессировалась из комплементарных векторов (рис. 1C). Из этих результатов мы пришли к выводу, что шесть компонентов T6SS, и . и . VgrG, TssA, TssE, TssF, TssG и TssK повышают эффективность образования трубок in vivo и, следовательно, контролируют сборку трубочек Hcp. TssE и VgrG имеют структурную гомологию с белком gp25 и комплексом gp27-gp5 (концентратор) соответственно [16,19,35,38].Во время морфогенеза бактериофага Т4 сборка хвостовой трубки инициируется на базовой пластинке только после рекрутирования комплекса (gp27-gp5) hub, в то время как субъединица gp25 необходима для функциональной сборки базовой пластинки [39]. Наблюдение, что сборка Hcp была нарушена в клетках vgrG и tssE , таким образом, согласуется с путем сборки бактериофагов и дополнительно подтверждает первоначальную гипотезу о том, что надлежащая полимеризация трубок Hcp зависит от структуры, подобной базовой пластине.На основании этих наблюдений мы предположили, что TssA, TssF, TssG и TssK могут образовывать вместе с TssE и VgrG платформу, сходную с базовой пластинкой бактериофага.
1C). Из этих результатов мы пришли к выводу, что шесть компонентов T6SS, и . и . VgrG, TssA, TssE, TssF, TssG и TssK повышают эффективность образования трубок in vivo и, следовательно, контролируют сборку трубочек Hcp. TssE и VgrG имеют структурную гомологию с белком gp25 и комплексом gp27-gp5 (концентратор) соответственно [16,19,35,38].Во время морфогенеза бактериофага Т4 сборка хвостовой трубки инициируется на базовой пластинке только после рекрутирования комплекса (gp27-gp5) hub, в то время как субъединица gp25 необходима для функциональной сборки базовой пластинки [39]. Наблюдение, что сборка Hcp была нарушена в клетках vgrG и tssE , таким образом, согласуется с путем сборки бактериофагов и дополнительно подтверждает первоначальную гипотезу о том, что надлежащая полимеризация трубок Hcp зависит от структуры, подобной базовой пластине.На основании этих наблюдений мы предположили, что TssA, TssF, TssG и TssK могут образовывать вместе с TssE и VgrG платформу, сходную с базовой пластинкой бактериофага. Однако в то время как субъединицы TssE, TssK и VgrG были ранее охарактеризованы [16, 38, 40], имеется мало информации о TssA, TssF и TssG. Исследование биоинформатики, опубликованное Boyer et al . продемонстрировали высокий уровень совпадения генов tssE (COG3518), tssF (COG3519) и tssG (COG3520). tssE и tssF генетически связаны в 87% кластеров генов T6SS, тогда как совместная организация tssF и tssG происходит в 97% этих кластеров ([2], рис. 2А). Как отметили Бойер и соавторы [2], одновременное появление обычно отражает белок-белковые взаимодействия. Действительно, ниже мы покажем, что TssF и TssG являются двумя компонентами базовой платы T6SS. Напротив, в этом исследовании не было замечено совместного появления гена tssA (COG3515) с tssE , vgrG или hcp .Хотя TssA необходим для формирования трубки Hcp, мы сообщим в другом месте, что он не является компонентом T6SS per se (Zoued, Durand et al.
Однако в то время как субъединицы TssE, TssK и VgrG были ранее охарактеризованы [16, 38, 40], имеется мало информации о TssA, TssF и TssG. Исследование биоинформатики, опубликованное Boyer et al . продемонстрировали высокий уровень совпадения генов tssE (COG3518), tssF (COG3519) и tssG (COG3520). tssE и tssF генетически связаны в 87% кластеров генов T6SS, тогда как совместная организация tssF и tssG происходит в 97% этих кластеров ([2], рис. 2А). Как отметили Бойер и соавторы [2], одновременное появление обычно отражает белок-белковые взаимодействия. Действительно, ниже мы покажем, что TssF и TssG являются двумя компонентами базовой платы T6SS. Напротив, в этом исследовании не было замечено совместного появления гена tssA (COG3515) с tssE , vgrG или hcp .Хотя TssA необходим для формирования трубки Hcp, мы сообщим в другом месте, что он не является компонентом T6SS per se (Zoued, Durand et al. ., в процессе подготовки). Поэтому мы сосредоточили нашу дальнейшую работу на двух неохарактеризованных генах tssF и tssG .
., в процессе подготовки). Поэтому мы сосредоточили нашу дальнейшую работу на двух неохарактеризованных генах tssF и tssG .
Рис. 1. Дефекты сборки Hcp в мутантных клетках vgrG , tssA , tssK , tssE , tssF и tssG .
(A) Экстракты клеток WT или Δ sci-1 EAEC, продуцирующих Hcp C38S (дорожка 1,-), Hcp C38S G96C S158C (дорожка 2, для исследования упаковки «голова к хвосту», HT), Hcp C38S Q24C A95C (дорожка 3, для исследования упаковки «голова к голове», HH) или Hcp C38S G48C (дорожка 4, для исследования упаковки «хвост к хвосту», TT) после окислительной обработки in vivo фенантролином меди.(B) и (C) Экстракты из клеток EAEC Δ tss (B) или клеток Δ tss , продуцирующих недостающий ген из комплементационных векторов pBAD33 ( tss +) (C) и продуцирующих Hcp C38S (-), Hcp C38S G96C S158C (дорожка 2, HT), Hcp C38S Q24C A95C (дорожка 3, HH) или Hcp C38S G48C (дорожка 4, TT) после окислительной обработки in vivo фенантролином меди. Образцы разделяли на SDS-ПААГ с 12,5%-ным акриламидом, а комплексы Hcp и Hcp подвергали иммунодетекции с моноклональным антителом против FLAG.Маркеры молекулярной массы указаны справа.
Образцы разделяли на SDS-ПААГ с 12,5%-ным акриламидом, а комплексы Hcp и Hcp подвергали иммунодетекции с моноклональным антителом против FLAG.Маркеры молекулярной массы указаны справа.
https://doi.org/10.1371/journal.pgen.1005545.g001
Рис. 2. Гены tssE , tssF и tssG встречаются совместно в кластерах генов T6SS и имеют общие гомологии с компонентами базовой пластинки фага.
(A) Схематическое представление генов tssE , tssF и tssG с соответствующими номерами COG (кластеры ортологичных групп [59]). Указана также гомология между TssE и белком gp25 бактериофага Т4.Число на черной полосе между двумя генами указывает на уровень одновременной встречаемости двух генов в бактериальных геномах (адаптировано из [2]). (B) Схематические изображения семейств белков PHA02553 и TIGR02243 (с репрезентативными членами — клиновидными белками gp6 бактериофага T4 и gpJ бактериофага P2 соответственно) и TssF. Указано количество аминокислотных остатков для каждого белка, а также фрагмент gp6, для которого имеется кристаллическая структура (PDB 3h3T, [48]). Области гомологии между различными белками обозначены серыми областями (указаны границы аминокислотных остатков). (C) и (D) Крупные планы областей гомологии между TssF, PHA02553 и TIGR02243 и между TssG и TIGR02242 (представитель: клиновидный белок gpI из бактериофага P2). Указаны предсказанные вторичные структуры (зеленый, -спираль; красный, -тяж). Серые области обозначают области гомологии (указаны границы аминокислотных остатков).
Области гомологии между различными белками обозначены серыми областями (указаны границы аминокислотных остатков). (C) и (D) Крупные планы областей гомологии между TssF, PHA02553 и TIGR02243 и между TssG и TIGR02242 (представитель: клиновидный белок gpI из бактериофага P2). Указаны предсказанные вторичные структуры (зеленый, -спираль; красный, -тяж). Серые области обозначают области гомологии (указаны границы аминокислотных остатков).
https://дои.org/10.1371/journal.pgen.1005545.g002
ЦсФ и ЦсГ являются составными частями базовой платы T6SS
Биоинформатический анализ: TssF и TssG являются гомологами хвостовых белков фага. Чтобы получить дополнительное представление о TssF и TssG, мы провели биоинформатический анализ с использованием HHPred (обнаружение гомологии и предсказание структуры, [41]). Белковые последовательности Sci-1 EAEC TssF (номер доступа: EC042_4542; идентификатор гена: 387609963) и TssG (номер доступа: EC042_4543; идентификатор гена: 387609964) использовали в качестве приманок для идентификации гомологов в бактериофагах. Анализы HHpred с TssF показали, что фрагмент, содержащий остатки 7–144 (более 587), напоминает область 9–132 фагового хвостоподобного белка TIGR02243 (PFAM04865), прототипом которого является белок J фага P2. Сегмент, включающий остатки 86–179, также имеет общие вторичные структуры с остатками 89–178 gp6, клиновидного компонента базовой пластинки бактериофага T4 (Fig. 2B и 2C). Точно так же фрагмент TssG, содержащий остатки 37–152 (более 303), напоминает область 4–110 фагового хвостоподобного белка TIGR02242 (PFAM09684), прототипом которого является белок I фага P2 (рис. 2D).Базовая пластинка фага Р2 состоит из четырех субъединиц: V, W, I и J [32]. Белок V является гомологом комплекса gp27-gp5 бактериофага T4 (VgrG) [42], тогда как белок W является гомологом gp25 (TssE). Leiman & Shneider недавно выдвинули гипотезу о том, что базовая пластинка с минимальной сократительной структурой собирается из центрального узла (gp27-gp5 и белка V у бактериофагов T4 и P2 соответственно) и трех ключевых клиновидных белков (gp25, gp6 и gp53) у бактериофага T4.
Анализы HHpred с TssF показали, что фрагмент, содержащий остатки 7–144 (более 587), напоминает область 9–132 фагового хвостоподобного белка TIGR02243 (PFAM04865), прототипом которого является белок J фага P2. Сегмент, включающий остатки 86–179, также имеет общие вторичные структуры с остатками 89–178 gp6, клиновидного компонента базовой пластинки бактериофага T4 (Fig. 2B и 2C). Точно так же фрагмент TssG, содержащий остатки 37–152 (более 303), напоминает область 4–110 фагового хвостоподобного белка TIGR02242 (PFAM09684), прототипом которого является белок I фага P2 (рис. 2D).Базовая пластинка фага Р2 состоит из четырех субъединиц: V, W, I и J [32]. Белок V является гомологом комплекса gp27-gp5 бактериофага T4 (VgrG) [42], тогда как белок W является гомологом gp25 (TssE). Leiman & Shneider недавно выдвинули гипотезу о том, что базовая пластинка с минимальной сократительной структурой собирается из центрального узла (gp27-gp5 и белка V у бактериофагов T4 и P2 соответственно) и трех ключевых клиновидных белков (gp25, gp6 и gp53) у бактериофага T4. ; Белки W, I и J бактериофага Р2) [22].Предсказанная структурная гомология предполагает, что N-концевая область TssF соответствует N-концевой области gp6, тогда как TssG (и белок I фага P2) соответствует gp53. Поэтому мы предполагаем, что базовая пластинка T6SS состоит как минимум из четырех субъединиц (VgrG (gp27-gp5; V), TssE (gp25; W), TssF (gp6; J) и TssG (gp53; I).
; Белки W, I и J бактериофага Р2) [22].Предсказанная структурная гомология предполагает, что N-концевая область TssF соответствует N-концевой области gp6, тогда как TssG (и белок I фага P2) соответствует gp53. Поэтому мы предполагаем, что базовая пластинка T6SS состоит как минимум из четырех субъединиц (VgrG (gp27-gp5; V), TssE (gp25; W), TssF (gp6; J) и TssG (gp53; I).
Функция
T6SS: TssF и TssG необходимы для полимеризации оболочки и высвобождения Hcp. Серия элегантных исследований, сочетающих генетические и биохимические подходы к визуализации с помощью электронной микроскопии, продемонстрировала, что во время морфогенеза частиц бактериофагов отсутствие компонентов базовой пластины предотвращает полимеризацию внутренней трубки и внешней оболочки [31,39,43–45].Здесь мы следили за динамикой хромосомно-кодируемого слитого белка TssB-mCherry (TssB mCh ) с использованием покадровой флуоресцентной микроскопии. Мы наблюдали, что сборка оболочки отменяется в клетках tssF и tssG (рис. S1A). В соответствии с отсутствием полимеризации и сжатия оболочки вестерн-блот-анализ культуральных супернатантов показал, что клетки tssF и tssG не выделяют Hcp в среду (S1B Fig).
S1A). В соответствии с отсутствием полимеризации и сжатия оболочки вестерн-блот-анализ культуральных супернатантов показал, что клетки tssF и tssG не выделяют Hcp в среду (S1B Fig).
Сеть взаимодействия: TssF и TssG взаимодействуют с TssE, VgrG, TssK, Hcp и TssC.Чтобы получить дополнительную информацию о партнерах TssF и TssG, мы использовали систематический подход, основанный на бактериальном двухгибридном (BTH). Трансляционные слияния T18-TssF/G и TssF/G-T18 тестировали в отношении родственных фагам основных компонентов T6SS (TssB, TssC, Hcp, TssE, VgrG и TssA), слитых с доменом T25. Как показано на рис. 3А, TssF взаимодействует с Hcp, тогда как TssG взаимодействует с TssC, Hcp и TssE. Затем эти парные взаимодействия тестировали коиммунопреципитацией в гетерологичном хозяине E . кишечная палочка К-12.На фиг. 3B показано, что Hcp, меченный HA, подвергался совместной иммунопреципитации с TssF или TssG, меченным FLAG. На рис. 3C показано, что TssG, меченный HA, коиммунопреципитировался с TssE, меченным FLAG. Интересно, что меченный HA TssF также специфически коиммунопреципитировался с TssE (рис. 3D), хотя анализ BTH не смог обнаружить это взаимодействие. Взятые вместе, анализы BTH и ко-иммунопреципитации свидетельствуют о том, что TssF и TssG взаимодействуют с компонентами хвоста T6SS, включая белок базовой пластинки TssE, а также с белками трубочки и оболочки Hcp и TssC.Эти данные предоставляют дополнительные доказательства в поддержку анализа сборки Hcp и биоинформатического анализа, чтобы предположить, что TssF и TssG образуют с TssE и VgrG базовую пластину T6SS, на которой полимеризуются трубка (Hcp) и оболочка (TssBC).
Интересно, что меченный HA TssF также специфически коиммунопреципитировался с TssE (рис. 3D), хотя анализ BTH не смог обнаружить это взаимодействие. Взятые вместе, анализы BTH и ко-иммунопреципитации свидетельствуют о том, что TssF и TssG взаимодействуют с компонентами хвоста T6SS, включая белок базовой пластинки TssE, а также с белками трубочки и оболочки Hcp и TssC.Эти данные предоставляют дополнительные доказательства в поддержку анализа сборки Hcp и биоинформатического анализа, чтобы предположить, что TssF и TssG образуют с TssE и VgrG базовую пластину T6SS, на которой полимеризуются трубка (Hcp) и оболочка (TssBC).
Рис. 3. TssF и TssG взаимодействуют с фагоподобными компонентами T6SS.
(A) Бактериальный двухгибридный анализ. Репортерные клетки BTh201, продуцирующие указанные белки, слитые с доменом Т18 или Т25 аденилатциклазы Bordetella , наносили на чашки с добавлением ИПТГ и хромогенного субстрата X-Gal.Взаимодействие между двумя слитыми белками подтверждается синим цветом колонии. Взаимодействие TolB-Pal служит положительным контролем. (B, C, D) анализы ко-иммунопреципитации. (B) TssF и TssG взаимодействуют с трубкообразующим белком Hcp. Растворимые экстракты E . Штамм coli K-12 W3110, продуцирующий TssF или TssG, меченный FLAG, и Hcp, меченный HA, подвергали иммунопреципитации с помощью гранул, связанных с анти-FLAG. Исходный материал (общий растворимый материал, T) и иммунопреципитированный материал (IP) загружали на 12.5%-акриламид SDS-PAGE и иммунодетекция с моноклональными антителами против FLAG и против HA. Иммунодетектируемые белки указаны справа. Маркеры молекулярной массы указаны слева. (C и D) TssG (C) и TssF (D) взаимодействуют с gp25-подобной субъединицей TssE. Растворимые экстракты E . Штамм coli K-12 W3110, продуцирующий TssF, меченный HA, и TssE, меченный FLAG, или TssG, меченный VSV-G, и TssE, меченный FLAG (правая панель), подвергали иммунопреципитации с использованием гранул, связанных с анти-FLAG.Исходный материал (общий растворимый материал, T) и иммунопреципитированный материал (IP) загружали в SDS-PAGE с 12,5% акриламидом и подвергали иммунодетекции с помощью моноклональных антител против FLAG, против HA и против VSV-G.
Взаимодействие TolB-Pal служит положительным контролем. (B, C, D) анализы ко-иммунопреципитации. (B) TssF и TssG взаимодействуют с трубкообразующим белком Hcp. Растворимые экстракты E . Штамм coli K-12 W3110, продуцирующий TssF или TssG, меченный FLAG, и Hcp, меченный HA, подвергали иммунопреципитации с помощью гранул, связанных с анти-FLAG. Исходный материал (общий растворимый материал, T) и иммунопреципитированный материал (IP) загружали на 12.5%-акриламид SDS-PAGE и иммунодетекция с моноклональными антителами против FLAG и против HA. Иммунодетектируемые белки указаны справа. Маркеры молекулярной массы указаны слева. (C и D) TssG (C) и TssF (D) взаимодействуют с gp25-подобной субъединицей TssE. Растворимые экстракты E . Штамм coli K-12 W3110, продуцирующий TssF, меченный HA, и TssE, меченный FLAG, или TssG, меченный VSV-G, и TssE, меченный FLAG (правая панель), подвергали иммунопреципитации с использованием гранул, связанных с анти-FLAG.Исходный материал (общий растворимый материал, T) и иммунопреципитированный материал (IP) загружали в SDS-PAGE с 12,5% акриламидом и подвергали иммунодетекции с помощью моноклональных антител против FLAG, против HA и против VSV-G. Иммунодетектируемые белки указаны справа. Маркеры молекулярной массы указаны слева. Звездочками обозначены легкие или тяжелые цепи антител. (E) Эксперименты по восстановлению. Очищенные лизаты клеток, продуцирующих VgrG-OB VSVG , TssE FL , TssF FL или TssG FL , смешивали, как указано (+), и комплексы подвергали иммунопреципитации с анти-VSV-G-связанными шариками.Иммунопреципитированные материалы загружали в SDS-PAGE с 12,5%-ным акриламидом и подвергали иммунодетекции с помощью моноклональных антител против VSV-G (верхняя панель) и против FLAG (нижняя панель). Mixes были TSSE FL , TSSF FL и TSSG FL в одиночку (LANE 1) или VGRG-OB VSVG с TSSE FL , TSSF FL и TSSG FL (Lane 2) или с TSSF ФЗ и ЦсГ ФЗ (полоса 3). Звездочками обозначены легкие или тяжелые цепи антител. (F) Бактериальный двухгибридный анализ.Репортерные клетки BTh201, продуцирующие указанные белки, слитые с доменом Т18 или Т25 аденилатциклазы Bordetella , и третьего партнера наносили на чашки с добавлением ИПТГ и хромогенного субстрата X-Gal.
Иммунодетектируемые белки указаны справа. Маркеры молекулярной массы указаны слева. Звездочками обозначены легкие или тяжелые цепи антител. (E) Эксперименты по восстановлению. Очищенные лизаты клеток, продуцирующих VgrG-OB VSVG , TssE FL , TssF FL или TssG FL , смешивали, как указано (+), и комплексы подвергали иммунопреципитации с анти-VSV-G-связанными шариками.Иммунопреципитированные материалы загружали в SDS-PAGE с 12,5%-ным акриламидом и подвергали иммунодетекции с помощью моноклональных антител против VSV-G (верхняя панель) и против FLAG (нижняя панель). Mixes были TSSE FL , TSSF FL и TSSG FL в одиночку (LANE 1) или VGRG-OB VSVG с TSSE FL , TSSF FL и TSSG FL (Lane 2) или с TSSF ФЗ и ЦсГ ФЗ (полоса 3). Звездочками обозначены легкие или тяжелые цепи антител. (F) Бактериальный двухгибридный анализ.Репортерные клетки BTh201, продуцирующие указанные белки, слитые с доменом Т18 или Т25 аденилатциклазы Bordetella , и третьего партнера наносили на чашки с добавлением ИПТГ и хромогенного субстрата X-Gal. Взаимодействие TolB-Pal служит положительным контролем.
Взаимодействие TolB-Pal служит положительным контролем.
https://doi.org/10.1371/journal.pgen.1005545.g003
У бактериофагов, таких как T4, шесть клиньев, образованных комплексом gp6-gp25-gp53, собираются вокруг центральной втулки. Поэтому мы проверили, взаимодействует ли комплекс TssE-F-G с VgrG, используя подход восстановления.Лизаты клеток, продуцирующих VgrG, меченный эпитопом VSV-G, и TssE, -F и -G, меченные FLAG, смешивали перед иммунопреципитацией на смоле против VSV-G. На рис. 3Е показано, что VgrG эффективно осаждает TssE, -F и -G. На основании этого результата и бактериального двухгибридного подхода (рис. 3А) мы предположили, что TssE связывает VgrG и TssF/TssG. Поэтому мы повторили эксперименты по иммунопреципитации в отсутствие TssE. Однако в этих условиях мы также наблюдали, что и TssF, и TssG ко-иммунопреципитируют с VgrG (рис. 3E).Поскольку мы не обнаружили прямых взаимодействий VgrG-TssF и VgrG-TssG в анализах BTH и ко-иммунопреципитации, эти результаты предполагают, что образование комплекса TssF-TssG необходимо для взаимодействия с VgrG. Действительно, эксперименты BTH показали, что взаимодействия VgrG-TssF и VgrG-TssG обнаруживаются, когда присутствует третий партнер, TssG и TssF соответственно (рис. 3F). Недавно сообщалось о стабильном комплексе TssKFG [46]. Однако мы не наблюдали взаимодействия между TssK и TssF или TssG ни в этом исследовании, ни при изучении систематического взаимодействия TssK [40].Интересно, что дальнейшие эксперименты с BTH показали, что и TssF, и TssG необходимы для стабильного взаимодействия с TssK (рис. 3F), аналогично тому, что мы наблюдали для VgrG. Таким образом, мы заключаем, что образование субкомплекса TssFG является предпосылкой для дальнейших взаимодействий с VgrG и TssK.
Действительно, эксперименты BTH показали, что взаимодействия VgrG-TssF и VgrG-TssG обнаруживаются, когда присутствует третий партнер, TssG и TssF соответственно (рис. 3F). Недавно сообщалось о стабильном комплексе TssKFG [46]. Однако мы не наблюдали взаимодействия между TssK и TssF или TssG ни в этом исследовании, ни при изучении систематического взаимодействия TssK [40].Интересно, что дальнейшие эксперименты с BTH показали, что и TssF, и TssG необходимы для стабильного взаимодействия с TssK (рис. 3F), аналогично тому, что мы наблюдали для VgrG. Таким образом, мы заключаем, что образование субкомплекса TssFG является предпосылкой для дальнейших взаимодействий с VgrG и TssK.
ЦсФ и ЦсГ взаимодействуют и стабилизируют друг друга
Описанные выше эксперименты и генетическое сцепление генов tssF и tssG позволяют предположить, что TssF и TssG взаимодействуют.Чтобы проверить эту гипотезу, мы сначала выполнили эксперименты по стационарной стабильности в E .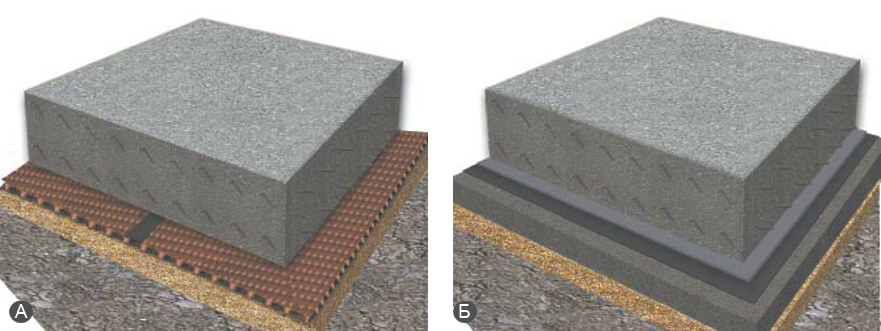 coli Клетки К-12, продуцирующие TssF, TssG или оба TssF и TssG. Клетки собирали в разные моменты времени после ингибирования синтеза белка и оценивали стабильность TssF и TssG с помощью вестерн-блоттинга. На фиг. 4А показано, что TssF и TssG, когда они продуцируются отдельно, являются относительно нестабильными белками, поскольку TssF и TssG не обнаруживаются через 120 и 60 минут после ингибирования синтеза белка соответственно.Однако оба белка стабилизировались при совместном продуцировании и оставались обнаруживаемыми до 8 часов после остановки синтеза белка. Этот результат показывает, что TssF и TssG стабилизируют друг друга. Совместная стабилизация этих двух белков согласуется с недавней работой, показывающей, что белки Serratia TssF и TssG нестабильны в отсутствие другого [46]. Чтобы проверить прямое взаимодействие, мы провели эксперименты с BTH и ко-иммунопреципитацией. Во-первых, анализ BTH показал, что (i) как TssF, так и TssG участвуют в гомотипических взаимодействиях, предполагая, что эти белки димеризуются или мультимеризуются, и (ii) что эти два белка взаимодействуют (Fig 4B).
coli Клетки К-12, продуцирующие TssF, TssG или оба TssF и TssG. Клетки собирали в разные моменты времени после ингибирования синтеза белка и оценивали стабильность TssF и TssG с помощью вестерн-блоттинга. На фиг. 4А показано, что TssF и TssG, когда они продуцируются отдельно, являются относительно нестабильными белками, поскольку TssF и TssG не обнаруживаются через 120 и 60 минут после ингибирования синтеза белка соответственно.Однако оба белка стабилизировались при совместном продуцировании и оставались обнаруживаемыми до 8 часов после остановки синтеза белка. Этот результат показывает, что TssF и TssG стабилизируют друг друга. Совместная стабилизация этих двух белков согласуется с недавней работой, показывающей, что белки Serratia TssF и TssG нестабильны в отсутствие другого [46]. Чтобы проверить прямое взаимодействие, мы провели эксперименты с BTH и ко-иммунопреципитацией. Во-первых, анализ BTH показал, что (i) как TssF, так и TssG участвуют в гомотипических взаимодействиях, предполагая, что эти белки димеризуются или мультимеризуются, и (ii) что эти два белка взаимодействуют (Fig 4B). Однако расположение слияния на С-конце TssF или на N-конце TssG вызывает стерические затруднения, препятствующие образованию комплекса TssF-TssG. Кроме того, белок TssF, меченный эпитопом HA, был специфически коиммунопреципитирован с TssG, меченным FLAG, в гетерологичном хозяине T6SS — E . coli K-12 (рис. 4C), демонстрируя, что это взаимодействие не опосредовано другими компонентами T6SS. В совокупности эти эксперименты демонстрируют, что TssF и TssG образуют комплекс, стабилизирующий обе субъединицы.Интересно, что в составе уропатогенного E . Кластер генов coli (UPEC) CFT073 T6SS, гены tssF и tssG сливаются, что приводит к химерному гену tssF’-‘tssG (см. рис. 4D). Выравнивание последовательности белка Clustal W белков EAEC TssF и TssG со слитым UPEC TssF-G показало, что С-концевые остатки PG TssF сливаются с N-концевыми остатками MGFP TssG с образованием мотива PGMGFP в слитом белке. (см. S2 рис.). Чтобы проверить, может ли слитый белок быть функциональным в EAEC, мы сконструировали мутантный штамм Δ tssFG и слили гены tssF и tssG в рамке считывания либо в нативном (FG-слияние), либо в противоположной ориентации (GF-слияние).
Однако расположение слияния на С-конце TssF или на N-конце TssG вызывает стерические затруднения, препятствующие образованию комплекса TssF-TssG. Кроме того, белок TssF, меченный эпитопом HA, был специфически коиммунопреципитирован с TssG, меченным FLAG, в гетерологичном хозяине T6SS — E . coli K-12 (рис. 4C), демонстрируя, что это взаимодействие не опосредовано другими компонентами T6SS. В совокупности эти эксперименты демонстрируют, что TssF и TssG образуют комплекс, стабилизирующий обе субъединицы.Интересно, что в составе уропатогенного E . Кластер генов coli (UPEC) CFT073 T6SS, гены tssF и tssG сливаются, что приводит к химерному гену tssF’-‘tssG (см. рис. 4D). Выравнивание последовательности белка Clustal W белков EAEC TssF и TssG со слитым UPEC TssF-G показало, что С-концевые остатки PG TssF сливаются с N-концевыми остатками MGFP TssG с образованием мотива PGMGFP в слитом белке. (см. S2 рис.). Чтобы проверить, может ли слитый белок быть функциональным в EAEC, мы сконструировали мутантный штамм Δ tssFG и слили гены tssF и tssG в рамке считывания либо в нативном (FG-слияние), либо в противоположной ориентации (GF-слияние). ).Оба слитых белка накапливались в сопоставимых количествах. Гены tssF и tssG также были клонированы непрерывно, имитируя их естественную генетическую организацию (F+G) в EAEC. Как и ожидалось, T6SS был нефункциональным в клетках Δ tssFG , поскольку Hcp не высвобождался ни в супернатанте культуры, ни в супернатанте клеток Δ tssFG , продуцирующих только TssF или TssG. Фенотип WT восстанавливался при продукции как TssF, так и TssG или слитого белка TssF-TssG; однако продукция «инвертированного» слитого белка TssG-TssF не смогла дополнить мутацию Δ tssFG (рис. 4E).В совокупности эти данные свидетельствуют о том, что TssF и TssG взаимодействуют. Наблюдение за тем, что слитый белок TssF-TssG является функциональным, предполагает, что TssF и TssG образуют субкомплекс со стехиометрией 1:1. Однако, используя количественное окрашивание геля, English et al . недавно сообщили о молярном соотношении 2:1 для комплекса Serratia TssF:G [46].
).Оба слитых белка накапливались в сопоставимых количествах. Гены tssF и tssG также были клонированы непрерывно, имитируя их естественную генетическую организацию (F+G) в EAEC. Как и ожидалось, T6SS был нефункциональным в клетках Δ tssFG , поскольку Hcp не высвобождался ни в супернатанте культуры, ни в супернатанте клеток Δ tssFG , продуцирующих только TssF или TssG. Фенотип WT восстанавливался при продукции как TssF, так и TssG или слитого белка TssF-TssG; однако продукция «инвертированного» слитого белка TssG-TssF не смогла дополнить мутацию Δ tssFG (рис. 4E).В совокупности эти данные свидетельствуют о том, что TssF и TssG взаимодействуют. Наблюдение за тем, что слитый белок TssF-TssG является функциональным, предполагает, что TssF и TssG образуют субкомплекс со стехиометрией 1:1. Однако, используя количественное окрашивание геля, English et al . недавно сообщили о молярном соотношении 2:1 для комплекса Serratia TssF:G [46]. Хотя наши данные предполагают стехиометрию 1:1, мы не можем исключить, что сконструированный нами слитый белок TssF-G подвергается частичной деградации.У бактериофага Т4 отмечено соотношение 2:1 для комплекса gp6:gp53 [31], что согласуется с данными Serratia [46].
Хотя наши данные предполагают стехиометрию 1:1, мы не можем исключить, что сконструированный нами слитый белок TssF-G подвергается частичной деградации.У бактериофага Т4 отмечено соотношение 2:1 для комплекса gp6:gp53 [31], что согласуется с данными Serratia [46].
Рис. 4. ЦсФ и ЦсГ взаимодействуют и стабилизируют друг друга.
(A) ЦсФ и ЦсГ стабилизируются при совместном производстве. Стационарные уровни белков TssF HA и TssG FL , продуцируемых по отдельности или вместе, анализировали с помощью вестерн-блоттинга целых клеток с использованием моноклональных антител против HA или против FLAG. Стабильный липопротеин Pal использовали в качестве контроля нагрузки.Указаны инкубационные периоды (мин) после обработки спектиномицином/хлорамфениколом. (B) Бактериальный двухгибридный анализ. Репортерные клетки BTh201, продуцирующие указанные белки, слитые с доменом Т18 или Т25 аденилатциклазы Bordetella , наносили на чашки с добавлением IPTG и хромогенного субстрата Бромо-хлор-индолил-β-D-галактопиранозид. Взаимодействие между двумя слитыми белками подтверждается синим цветом колонии. Взаимодействие TolB-Pal служит положительным контролем.(C) TssF ко-иммунопреципитирует с TssG. Растворимые экстракты E . Штамм coli K-12 W3110, продуцирующий TssF HA и TssG FL , подвергали иммунопреципитации гранулами, связанными с анти-FLAG. Общий растворимый материал (T) и иммунопреципитированный материал (IP) наносили на SDS-PAGE с 12,5%-ным акриламидом и подвергали иммунодетекции с помощью моноклональных антител против HA и против FLAG. Иммунодетектируемые белки указаны справа. Маркеры молекулярной массы указаны слева.(D) Генетическая организация генов tssF и tssG в EAEC 17-2 и E . coli УПЭК CFT073. Ортологичные гены схематично показаны одним цветом. Выравнивание Clustal W между EAEC TssF и TssG и белком CFT073 NP_755275 представлено на рис. S2. (E) Слитый белок TssF-TssG является функциональным. Высвобождение Hcp FLAG оценивали путем разделения фракций целых клеток (C) и супернатантов (S) из культур клеток WT, tssFG и комплементарных tssFG .
Взаимодействие между двумя слитыми белками подтверждается синим цветом колонии. Взаимодействие TolB-Pal служит положительным контролем.(C) TssF ко-иммунопреципитирует с TssG. Растворимые экстракты E . Штамм coli K-12 W3110, продуцирующий TssF HA и TssG FL , подвергали иммунопреципитации гранулами, связанными с анти-FLAG. Общий растворимый материал (T) и иммунопреципитированный материал (IP) наносили на SDS-PAGE с 12,5%-ным акриламидом и подвергали иммунодетекции с помощью моноклональных антител против HA и против FLAG. Иммунодетектируемые белки указаны справа. Маркеры молекулярной массы указаны слева.(D) Генетическая организация генов tssF и tssG в EAEC 17-2 и E . coli УПЭК CFT073. Ортологичные гены схематично показаны одним цветом. Выравнивание Clustal W между EAEC TssF и TssG и белком CFT073 NP_755275 представлено на рис. S2. (E) Слитый белок TssF-TssG является функциональным. Высвобождение Hcp FLAG оценивали путем разделения фракций целых клеток (C) и супернатантов (S) из культур клеток WT, tssFG и комплементарных tssFG . Клетки tssFG комплементировали либо плазмидой, несущей гены tssF и tssG , расположенные непрерывно (F+G), либо слияние tssF’-‘tssG (FG), либо слияние tssG’-‘tssF ГФ). В общей сложности 2×10 8 клеток и ТХУ-преципитированный материал супернатанта из 5×10 8 клеток наносили на SDS-PAGE с 12,5%-ным акриламидом и подвергали иммунодетекции с использованием моноклонального антитела против FLAG (нижняя панель). ) и поликлональные антитела против TolB (контроль целостности клеток; верхняя панель).
Клетки tssFG комплементировали либо плазмидой, несущей гены tssF и tssG , расположенные непрерывно (F+G), либо слияние tssF’-‘tssG (FG), либо слияние tssG’-‘tssF ГФ). В общей сложности 2×10 8 клеток и ТХУ-преципитированный материал супернатанта из 5×10 8 клеток наносили на SDS-PAGE с 12,5%-ным акриламидом и подвергали иммунодетекции с использованием моноклонального антитела против FLAG (нижняя панель). ) и поликлональные антитела против TolB (контроль целостности клеток; верхняя панель).
https://doi.org/10.1371/journal.pgen.1005545.g004
TssF и TssG представляют собой растворимые цитоплазматические субъединицы, рекрутируемые в IM с помощью TssM
Чтобы получить представление о TssF и TssG, мы дополнительно проверили их субклеточную локализацию, используя эксперименты по клеточному фракционированию. В клетках дикого типа как TssF, так и TssG в основном совместно фракционируются с EFTu, цитоплазматическим фактором удлинения (рис. 5А). Неожиданно было обнаружено, что небольшие, но воспроизводимые количества TssF и TssG связаны с мембранной фракцией (рис. 5А).TssF и TssG совместно фракционируют с белком IM TolA, а активность NADH-оксидазы в экспериментах с градиентом плотности седиментации указывает на то, что оба белка связываются с внутренней мембраной (IM) (рис. 5B). Эти результаты свидетельствуют о том, что TssF и TssG периферически связаны с IM, вероятно, посредством белок-белковых контактов. Интересно, что оба белка локализованы исключительно в цитоплазматических фракциях E . coli K-12 ( i . e ., лишенных генов T6SS) (рис. 5C), что еще раз подтверждает мнение о том, что TssF и TssG связаны с внутренней мембраной компонентом T6SS.
5А). Неожиданно было обнаружено, что небольшие, но воспроизводимые количества TssF и TssG связаны с мембранной фракцией (рис. 5А).TssF и TssG совместно фракционируют с белком IM TolA, а активность NADH-оксидазы в экспериментах с градиентом плотности седиментации указывает на то, что оба белка связываются с внутренней мембраной (IM) (рис. 5B). Эти результаты свидетельствуют о том, что TssF и TssG периферически связаны с IM, вероятно, посредством белок-белковых контактов. Интересно, что оба белка локализованы исключительно в цитоплазматических фракциях E . coli K-12 ( i . e ., лишенных генов T6SS) (рис. 5C), что еще раз подтверждает мнение о том, что TssF и TssG связаны с внутренней мембраной компонентом T6SS.
Рис. 5. TssF и TssG представляют собой растворимые белки, которые связываются с IM посредством контактов между TssG и цитоплазматической петлей TssM.
(A) Процедура фракционирования была применена к клеткам EAEC, продуцирующим TssF HA и TssG FL (T, общая фракция), что позволило разделить периплазматическую (P), цитоплазматическую (C) и мембранную фракции (M) . Образцы загружали в SDS-PAGE с 12,5% акриламидом и иммунодетектировали антителами, направленными против белков EFTu (цитоплазма), TolB (периплазма), белков OmpA (OM) и эпитопа HA TssF или эпитопа FLAG TssG.Маркеры молекулярной массы указаны слева. (B) Тотальные мембраны (T) из клеток EAEC, продуцирующих TssF HA и TssG FL , разделяли в градиенте прерывистой седиментации сахарозы. Собранные фракции анализировали на содержание с использованием поликлональных антител анти-TolA и анти-OmpA или моноклональных антител анти-HA и анти-FLAG. Кроме того, тест активности НАДН-оксидазы (график) использовали в качестве репортера фракций, содержащих белок внутренней мембраны. Активность НАДН-оксидазы представлена относительно общей активности.Указано положение фракций, содержащих внутреннюю и внешнюю мембраны. (C) Процедура фракционирования была применена к E . Клетки coli K-12 W3110, продуцирующие TssF HA и TssG FLAG (T, общая фракция), позволяют разделить периплазму (P), цитоплазму (C) и мембранные фракции (M).
Образцы загружали в SDS-PAGE с 12,5% акриламидом и иммунодетектировали антителами, направленными против белков EFTu (цитоплазма), TolB (периплазма), белков OmpA (OM) и эпитопа HA TssF или эпитопа FLAG TssG.Маркеры молекулярной массы указаны слева. (B) Тотальные мембраны (T) из клеток EAEC, продуцирующих TssF HA и TssG FL , разделяли в градиенте прерывистой седиментации сахарозы. Собранные фракции анализировали на содержание с использованием поликлональных антител анти-TolA и анти-OmpA или моноклональных антител анти-HA и анти-FLAG. Кроме того, тест активности НАДН-оксидазы (график) использовали в качестве репортера фракций, содержащих белок внутренней мембраны. Активность НАДН-оксидазы представлена относительно общей активности.Указано положение фракций, содержащих внутреннюю и внешнюю мембраны. (C) Процедура фракционирования была применена к E . Клетки coli K-12 W3110, продуцирующие TssF HA и TssG FLAG (T, общая фракция), позволяют разделить периплазму (P), цитоплазму (C) и мембранные фракции (M). Образцы загружали в SDS-PAGE с 12,5% акриламидом и подвергали иммунодетекции антителами, направленными против белков EFTu (цитоплазма), TolB (периплазма), TolA (IM) и эпитопа HA TssF или эпитопа FLAG TssG.Маркеры молекулярной массы указаны слева. (D) Бактериальный двухгибридный анализ. Репортерные клетки BTh201, продуцирующие указанные белки, слитые с доменом Т18 или Т25 аденилатциклазы Bordetella , наносили на чашки с добавлением IPTG и хромогенного субстрата Бромо-хлор-индолил-β-D-галактопиранозид. Взаимодействие между двумя слитыми белками подтверждается синим цветом колонии. Взаимодействие TolB-Pal служит положительным контролем. (E) TssG ко-иммунопреципитирует с цитоплазматическим доменом TssM (TssMc, аминокислоты 82–360).Растворимые экстракты E . Штамм coli K-12 W3110, продуцирующий только TssG VSVG , или TssG VSVG и TssMc FL подвергали иммунопреципитации с использованием гранул, связанных с анти-FLAG. Общий растворимый материал (T) и иммунопреципитированный материал (IP) наносили на SDS-PAGE с 12,5%-ным акриламидом и иммунодетектировали с помощью моноклональных антител против VSVG и против FLAG (дополнительные полосы соответствуют тяжелым цепям антител).
Образцы загружали в SDS-PAGE с 12,5% акриламидом и подвергали иммунодетекции антителами, направленными против белков EFTu (цитоплазма), TolB (периплазма), TolA (IM) и эпитопа HA TssF или эпитопа FLAG TssG.Маркеры молекулярной массы указаны слева. (D) Бактериальный двухгибридный анализ. Репортерные клетки BTh201, продуцирующие указанные белки, слитые с доменом Т18 или Т25 аденилатциклазы Bordetella , наносили на чашки с добавлением IPTG и хромогенного субстрата Бромо-хлор-индолил-β-D-галактопиранозид. Взаимодействие между двумя слитыми белками подтверждается синим цветом колонии. Взаимодействие TolB-Pal служит положительным контролем. (E) TssG ко-иммунопреципитирует с цитоплазматическим доменом TssM (TssMc, аминокислоты 82–360).Растворимые экстракты E . Штамм coli K-12 W3110, продуцирующий только TssG VSVG , или TssG VSVG и TssMc FL подвергали иммунопреципитации с использованием гранул, связанных с анти-FLAG. Общий растворимый материал (T) и иммунопреципитированный материал (IP) наносили на SDS-PAGE с 12,5%-ным акриламидом и иммунодетектировали с помощью моноклональных антител против VSVG и против FLAG (дополнительные полосы соответствуют тяжелым цепям антител). Иммунодетектируемые белки указаны справа.Маркеры молекулярной массы указаны слева. (F) TssF и TssG остаются цитоплазматическими в делеционном мутанте tssM . Процедура фракционирования была применена к клеткам EAEC tssM , совместно продуцирующим TssF HA и TssG FL (T, общая фракция), что позволило разделить периплазму (P), цитоплазму (C) и мембранные фракции (M). . Образцы загружали в SDS-PAGE с 12,5% акриламидом и подвергали иммунодетекции антителами, направленными против белков EFTu (цитоплазма), TolB (периплазма), TolA (IM) и эпитопа HA TssF или эпитопа FLAG TssG.Маркеры молекулярной массы указаны слева.
Иммунодетектируемые белки указаны справа.Маркеры молекулярной массы указаны слева. (F) TssF и TssG остаются цитоплазматическими в делеционном мутанте tssM . Процедура фракционирования была применена к клеткам EAEC tssM , совместно продуцирующим TssF HA и TssG FL (T, общая фракция), что позволило разделить периплазму (P), цитоплазму (C) и мембранные фракции (M). . Образцы загружали в SDS-PAGE с 12,5% акриламидом и подвергали иммунодетекции антителами, направленными против белков EFTu (цитоплазма), TolB (периплазма), TolA (IM) и эпитопа HA TssF или эпитопа FLAG TssG.Маркеры молекулярной массы указаны слева.
https://doi.org/10.1371/journal.pgen.1005545.g005
Три белка T6SS взаимодействуют, образуя ассоциированный с мембраной комплекс, который охватывает клеточную оболочку: белки внутренней мембраны TssL и TssM и липопротеин внешней мембраны TssJ [12–15]. Чтобы идентифицировать партнеров TssF и TssG, мы проверили их взаимодействие с растворимыми доменами TssL, TssM и TssJ с помощью BTH. Как показано на рис. 5D, TssG взаимодействует с цитоплазматической петлей белка внутренней мембраны TssM (TssMc).Этот результат был подтвержден ко-иммунопреципитацией: меченный HA TssG подвергался ко-иммунопреципитации с доменом TssMc, меченным FLAG (фиг. 5E). Гипотеза о привлечении TssF и TssG к мембране посредством взаимодействия с TssM была проверена путем клеточного фракционирования в клетках Δ tssM . На рис. 5F показано, что в отсутствие TssM, TssF и TssG кофракционируют исключительно с цитоплазматическим маркером EFTu и больше не связываются с мембранной фракцией. В совокупности эти данные показывают, что TssF и TssG рекрутируются на цитоплазматической поверхности внутренней мембраны посредством взаимодействия с цитоплазматической петлей TssM.Однако ассоциация с мембранным комплексом может быть стабилизирована дополнительными контактами, включающими взаимодействия TssFG-TssK и TssK-TssL или TssK-TssM [40].
Как показано на рис. 5D, TssG взаимодействует с цитоплазматической петлей белка внутренней мембраны TssM (TssMc).Этот результат был подтвержден ко-иммунопреципитацией: меченный HA TssG подвергался ко-иммунопреципитации с доменом TssMc, меченным FLAG (фиг. 5E). Гипотеза о привлечении TssF и TssG к мембране посредством взаимодействия с TssM была проверена путем клеточного фракционирования в клетках Δ tssM . На рис. 5F показано, что в отсутствие TssM, TssF и TssG кофракционируют исключительно с цитоплазматическим маркером EFTu и больше не связываются с мембранной фракцией. В совокупности эти данные показывают, что TssF и TssG рекрутируются на цитоплазматической поверхности внутренней мембраны посредством взаимодействия с цитоплазматической петлей TssM.Однако ассоциация с мембранным комплексом может быть стабилизирована дополнительными контактами, включающими взаимодействия TssFG-TssK и TssK-TssL или TssK-TssM [40].
ЦсФ собирает стабильные и статические кластеры, на которых полимеризуется оболочка
Предыдущие данные свидетельствуют о том, что TssE,-F,-G,-K, VgrG собирают структуру базовой пластины, прикрепленную к мембранному комплексу T6SS. Основываясь на знаниях о бактериофагах, мы предположили, что эта базовая пластина служит сборочной платформой для удлинения хвостовой трубки / оболочки.Чтобы дополнительно получить информацию о расположении компонентов базовой пластины в клетках, рекрутировании и динамическом поведении, мы сконструировали штаммы, продуцирующие суперпапку GFP (sfGFP), слитую с N- или C-концом TssE, TssF, TssG и TssK. Все эти хромосомные конструкции были введены в нативные исходные локусы. Только слияния GFP-TssF ( sfGFP TssF) и TssK-GFP (TssK sfGFP ) были функциональными. В клетках дикого типа sfGFP TssF образует 1–3 очага на клетку, расположенные близко к цитоплазматической стороне оболочки и с ограниченной динамикой (рис. 6А [верхняя панель] и S3A и S3B).Количество очагов sfGFP TssF и их динамика остались неизменными в клетках tssBC , что свидетельствует о том, что сборка оболочки T6SS не влияет на формирование этих структур (рис. 6A и S3A и S3B).
Основываясь на знаниях о бактериофагах, мы предположили, что эта базовая пластина служит сборочной платформой для удлинения хвостовой трубки / оболочки.Чтобы дополнительно получить информацию о расположении компонентов базовой пластины в клетках, рекрутировании и динамическом поведении, мы сконструировали штаммы, продуцирующие суперпапку GFP (sfGFP), слитую с N- или C-концом TssE, TssF, TssG и TssK. Все эти хромосомные конструкции были введены в нативные исходные локусы. Только слияния GFP-TssF ( sfGFP TssF) и TssK-GFP (TssK sfGFP ) были функциональными. В клетках дикого типа sfGFP TssF образует 1–3 очага на клетку, расположенные близко к цитоплазматической стороне оболочки и с ограниченной динамикой (рис. 6А [верхняя панель] и S3A и S3B).Количество очагов sfGFP TssF и их динамика остались неизменными в клетках tssBC , что свидетельствует о том, что сборка оболочки T6SS не влияет на формирование этих структур (рис. 6A и S3A и S3B). Напротив, флуоресценция sfGFP TssF была диффузной в клетках tssK , демонстрируя, что TssK необходим для правильной сборки базовых пластин, содержащих TssF (рис. 6А). Поведение sfGFP TssF отличалось в клетках tssM . Хотя ~ 95% клеток имеют диффузную флуоресценцию, кластеры sfGFP TssF присутствуют в ~ 5% клеток.Эти кластеры не остаются тесно связанными с мембраной, а скорее демонстрируют случайную динамику (Fig. 6A), указывая на то, что мембранные комплексы стабилизируют и закрепляют комплексы базовой пластины на IM.
Напротив, флуоресценция sfGFP TssF была диффузной в клетках tssK , демонстрируя, что TssK необходим для правильной сборки базовых пластин, содержащих TssF (рис. 6А). Поведение sfGFP TssF отличалось в клетках tssM . Хотя ~ 95% клеток имеют диффузную флуоресценцию, кластеры sfGFP TssF присутствуют в ~ 5% клеток.Эти кластеры не остаются тесно связанными с мембраной, а скорее демонстрируют случайную динамику (Fig. 6A), указывая на то, что мембранные комплексы стабилизируют и закрепляют комплексы базовой пластины на IM.
Рис. 6. ЦсФ и ЦсК собираются в статические очаги, которые служат платформой для полимеризации оболочки.
(A) Покадровые записи флуоресцентной микроскопии, показывающие локализацию и динамику функционального слитого белка sfGFP TssF в клетках дикого типа (WT) (верхняя панель) или tssBC (вторая панель сверху) tssK ( третья панель сверху) или производные цсм (нижняя панель). Отдельные изображения делались каждые 30 секунд. Положения фокусов обозначены белыми треугольниками. Шкала баров составляет 1 м. Статистический анализ (количество очагов на клетку и динамика) показан на рисунках S3A и S3B. (B) События полимеризации оболочки инициируются в очагах sfGFP TssF. Покадровая запись флуоресцентной микроскопии клеток EAEC дикого типа, продуцирующих sfGFP TssF и TssB mCh . Показаны канал GFP (верхняя панель), канал mCherry (средняя панель) и каналы слияния (нижняя панель).Отдельные изображения (слева направо) делались каждые 30 секунд. Очаги базальной пластинки и дистальные концы влагалищ обозначены белыми стрелками. Схематическая диаграмма, обобщающая наблюдаемые события, приведена ниже. Масштабная линейка составляет 1 мкм. Статистический анализ (исходное расположение кластеров sfGFP TssF, процент оболочек с базальными фокусами sfGFP TssF) и кимографический анализ показаны на S3C, S3D и S3E. Рис. (C) Интервальная флуоресцентная микроскопия, показывающая локализацию и динамику функциональный слитый белок TssK sfGFP в клетках дикого типа (WT) (верхняя панель) или его производное tssM (нижняя панель).
Отдельные изображения делались каждые 30 секунд. Положения фокусов обозначены белыми треугольниками. Шкала баров составляет 1 м. Статистический анализ (количество очагов на клетку и динамика) показан на рисунках S3A и S3B. (B) События полимеризации оболочки инициируются в очагах sfGFP TssF. Покадровая запись флуоресцентной микроскопии клеток EAEC дикого типа, продуцирующих sfGFP TssF и TssB mCh . Показаны канал GFP (верхняя панель), канал mCherry (средняя панель) и каналы слияния (нижняя панель).Отдельные изображения (слева направо) делались каждые 30 секунд. Очаги базальной пластинки и дистальные концы влагалищ обозначены белыми стрелками. Схематическая диаграмма, обобщающая наблюдаемые события, приведена ниже. Масштабная линейка составляет 1 мкм. Статистический анализ (исходное расположение кластеров sfGFP TssF, процент оболочек с базальными фокусами sfGFP TssF) и кимографический анализ показаны на S3C, S3D и S3E. Рис. (C) Интервальная флуоресцентная микроскопия, показывающая локализацию и динамику функциональный слитый белок TssK sfGFP в клетках дикого типа (WT) (верхняя панель) или его производное tssM (нижняя панель). Отдельные изображения делались каждые 30 секунд. Положения фокусов обозначены белыми треугольниками. Шкала баров составляет 1 м. Статистический анализ (количество очагов на клетку и динамика) показан на S3B и S3F. Рис. (D) Покадровые записи флуоресцентной микроскопии, показывающие локализацию и динамику функционального слитого белка sfGFP TssM в клетках tssK . Отдельные изображения делались каждые 30 секунд. Положения фокусов обозначены белыми треугольниками. Шкала баров составляет 1 м.Статистический анализ (количество очагов на клетку) показан на рис. S3G. (E) Путь сборки между выбранными компонентами T6SS. Мембранный комплекс (МК), включающий белок TssJLM (показан электронной микроскопией структуры 11,6-А), собирается первым и используется в качестве стыковочной станции для TssK. TssK набирает комплекс TssF/TssG в аппарат для сборки комплекса базовой пластины (BC, зеленый прямоугольник) перед сборкой хвостового комплекса (TC, красный прямоугольник), включающего внутреннюю трубку Hcp и сократительную структуру, подобную оболочке TssBC.
Отдельные изображения делались каждые 30 секунд. Положения фокусов обозначены белыми треугольниками. Шкала баров составляет 1 м. Статистический анализ (количество очагов на клетку и динамика) показан на S3B и S3F. Рис. (D) Покадровые записи флуоресцентной микроскопии, показывающие локализацию и динамику функционального слитого белка sfGFP TssM в клетках tssK . Отдельные изображения делались каждые 30 секунд. Положения фокусов обозначены белыми треугольниками. Шкала баров составляет 1 м.Статистический анализ (количество очагов на клетку) показан на рис. S3G. (E) Путь сборки между выбранными компонентами T6SS. Мембранный комплекс (МК), включающий белок TssJLM (показан электронной микроскопией структуры 11,6-А), собирается первым и используется в качестве стыковочной станции для TssK. TssK набирает комплекс TssF/TssG в аппарат для сборки комплекса базовой пластины (BC, зеленый прямоугольник) перед сборкой хвостового комплекса (TC, красный прямоугольник), включающего внутреннюю трубку Hcp и сократительную структуру, подобную оболочке TssBC.
https://doi.org/10.1371/journal.pgen.1005545.g006
Записи флуоресцентной микроскопии клеток, продуцирующих как sfGFP TssF, так и mCherry-меченый TssB (TssB mCh ) из их нативных локусов хромосом Механизм T6SS: i) кластеры sfGFP TssF располагаются первыми (рис. 6B и S3C), и ii) оболочка TssB mCh простирается от предварительно собранного кластера sfGFP TssF (рис. 6B и S3D и S3E).Кроме того, записи показывают, что фокусов sfGFP и TssF остаются связанными с оболочкой в течение всего цикла (удлинение, сокращение и разборка) (рис. S3C и S3D). Эти наблюдения убедительно подтверждают модель, в которой комплексы, содержащие TssF, служат платформами для полимеризации оболочек. Слияние TssK sfGFP демонстрирует сходное поведение с sfGFP TssF: оно собирает 1–3 стабильных и статических очага на клетку и демонстрирует диффузную локализацию в отсутствие TssM (рис. 6C и S3B и S3F). Наоборот, sfGFP TssM образует дискретные очаги в клетках WT [15], которые собираются независимо от TssK (Figs 6D и S3G). Основываясь на этих результатах и в согласии с гипотезой, выдвинутой Инглишем и соавторами [46], мы предполагаем, что мембранный комплекс TssL-MJ служит местом стыковки хвостоподобной структуры T6SS, сборка которой начинается с последующие наборы TssK, TssFG, Hcp и TssBC (рис. 6E).
Наоборот, sfGFP TssM образует дискретные очаги в клетках WT [15], которые собираются независимо от TssK (Figs 6D и S3G). Основываясь на этих результатах и в согласии с гипотезой, выдвинутой Инглишем и соавторами [46], мы предполагаем, что мембранный комплекс TssL-MJ служит местом стыковки хвостоподобной структуры T6SS, сборка которой начинается с последующие наборы TssK, TssFG, Hcp и TssBC (рис. 6E).
Обсуждение
Недавние исследования показали, что T6SS собирает цитозольную структуру, подобную хвостовой трубке и оболочке сократительных бактериофагов [16,23–26].Во время морфогенеза бактериофага трубка и оболочка полимеризуются на базовой пластине, которая инициирует и направляет процесс сборки [29-31]. Кроме того, базовая пластинка претерпевает большие конформационные перестройки при приземлении на клетку-мишень, что в конечном итоге вызывает сокращение хвоста [30]. У бактериофага Т4 базальная пластинка представляет собой сложную структуру; однако простейшие базовые пластины существуют и у других сократительных бактериофагов. Основываясь на сравнении базовых пластинок, Leiman & Shneider предположили, что для функциональной базовой пластинки потребуются только четыре компонента: комплекс узлов gp27-gp5 (или шип) и клиновидные субъединицы gp25, gp6 и gp53 [22].Тем не менее, в T6SS неизвестна идентичность и состав базовой пластины, которая контролирует сборку конструкции трубка/оболочка [10–12,37]. Чтобы идентифицировать эти компоненты, мы разработали тест для исследования образования трубок Hcp in vivo [18]. Систематически применяя этот анализ во всех мутантных штаммах с делецией гена T6SS, мы идентифицировали шесть основных компонентов T6SS, необходимых для контролируемой полимеризации трубки Hcp. Этот экспериментальный подход был подтвержден тем фактом, что мы идентифицировали VgrG и TssE, гомологи T6SS комплекса шип/концентратор бактериофага и субъединицы gp25 соответственно.Среди четырех оставшихся субъединиц, TssA, TssK, TssF и TssG, мы показали, что две последние имеют ограниченную, но значительную гомологию с белками J и I, двумя компонентами базовой пластинки фага P2, соответственно [32,33].
Основываясь на сравнении базовых пластинок, Leiman & Shneider предположили, что для функциональной базовой пластинки потребуются только четыре компонента: комплекс узлов gp27-gp5 (или шип) и клиновидные субъединицы gp25, gp6 и gp53 [22].Тем не менее, в T6SS неизвестна идентичность и состав базовой пластины, которая контролирует сборку конструкции трубка/оболочка [10–12,37]. Чтобы идентифицировать эти компоненты, мы разработали тест для исследования образования трубок Hcp in vivo [18]. Систематически применяя этот анализ во всех мутантных штаммах с делецией гена T6SS, мы идентифицировали шесть основных компонентов T6SS, необходимых для контролируемой полимеризации трубки Hcp. Этот экспериментальный подход был подтвержден тем фактом, что мы идентифицировали VgrG и TssE, гомологи T6SS комплекса шип/концентратор бактериофага и субъединицы gp25 соответственно.Среди четырех оставшихся субъединиц, TssA, TssK, TssF и TssG, мы показали, что две последние имеют ограниченную, но значительную гомологию с белками J и I, двумя компонентами базовой пластинки фага P2, соответственно [32,33]..jpg) В дополнение к бактериофагам и T6SS, гомологи белков I и J базисной пластинки Р2, а также гомологи шипа/хаба и gp25 обнаружены в антипитающих профагах, кассетах Photorhabdus Virulence и R-пиоцинах [47], что позволяет предположить, что они, вероятно, представляют собой ядро механизмов транслокации фагоподобных белков.Схематическое сравнение гомологии и контактов между компонентами бактериофага T4 и T6SS показано на рис. S4. В этом исследовании мы сосредоточили нашу работу на белках TssF и TssG. Мы показали, что ЦсФ и ЦсГ взаимодействуют друг с другом и с ЦсЭ. Хотя мы не рассматривали биологическую значимость этих взаимодействий, эти результаты согласуются с совместным присутствием этих трех генов в кластерах генов T6SS [2], а также с наблюдением, что гомологи TssE и TssF бактериофага T4 – gp25 и gp6 – взаимодействуют [48].Интересно, что Aksyuk и соавт. показали, что взаимодействие gp6-gp25 включает N-концевой фрагмент gp6, фрагмент, имеющий гомологию с TssF [48]. Кроме того, были обнаружены контакты с TssK, VgrG и компонентами трубки (Hcp) и оболочки (TssC).
В дополнение к бактериофагам и T6SS, гомологи белков I и J базисной пластинки Р2, а также гомологи шипа/хаба и gp25 обнаружены в антипитающих профагах, кассетах Photorhabdus Virulence и R-пиоцинах [47], что позволяет предположить, что они, вероятно, представляют собой ядро механизмов транслокации фагоподобных белков.Схематическое сравнение гомологии и контактов между компонентами бактериофага T4 и T6SS показано на рис. S4. В этом исследовании мы сосредоточили нашу работу на белках TssF и TssG. Мы показали, что ЦсФ и ЦсГ взаимодействуют друг с другом и с ЦсЭ. Хотя мы не рассматривали биологическую значимость этих взаимодействий, эти результаты согласуются с совместным присутствием этих трех генов в кластерах генов T6SS [2], а также с наблюдением, что гомологи TssE и TssF бактериофага T4 – gp25 и gp6 – взаимодействуют [48].Интересно, что Aksyuk и соавт. показали, что взаимодействие gp6-gp25 включает N-концевой фрагмент gp6, фрагмент, имеющий гомологию с TssF [48]. Кроме того, были обнаружены контакты с TssK, VgrG и компонентами трубки (Hcp) и оболочки (TssC). Интересно, что контакты с TssK и VgrG требуют предварительного формирования комплекса TssF-G. В совокупности эти данные подтверждают идею о том, что базальная пластинка T6SS состоит из субъединиц VgrG, TssE, TssF, TssG и TssK, на которых последовательно полимеризуются трубка Hcp и оболочка TssB-TssC (рис. 7).Действительно, исследования совместной локализации показали, что TssF рекрутируется в аппарат до наращивания интродьюсера. Судя по наблюдениям, что эта базальная пластина пристыкована к мембранному комплексу и остается в основании вытянутого хвоста, она, вероятно, соответствует структуре, наблюдаемой в том же месте на электронных криотомографах T6SS [26].
Интересно, что контакты с TssK и VgrG требуют предварительного формирования комплекса TssF-G. В совокупности эти данные подтверждают идею о том, что базальная пластинка T6SS состоит из субъединиц VgrG, TssE, TssF, TssG и TssK, на которых последовательно полимеризуются трубка Hcp и оболочка TssB-TssC (рис. 7).Действительно, исследования совместной локализации показали, что TssF рекрутируется в аппарат до наращивания интродьюсера. Судя по наблюдениям, что эта базальная пластина пристыкована к мембранному комплексу и остается в основании вытянутого хвоста, она, вероятно, соответствует структуре, наблюдаемой в том же месте на электронных криотомографах T6SS [26].
Рис. 7. Сборка секреторной системы типа VI.
Схематическое изображение различных стадий биогенеза T6SS. Мембранный комплекс TssJ-LM сначала собирается в клеточной оболочке (IM, внутренняя мембрана; PG, пептидогликан; OM, внешняя мембрана) и рекрутирует подобную базовой пластине сборочную платформу, состоящую из TssE, TssF, TssG, TssK, VgrG и, возможно, TssA. (платформа в виде зеленого диска с зеленым винтом VgrG).Полимеризация хвостовой трубы (кольца Hcp, черные прямоугольники) и оболочки (нити TssBC, красные прямоугольники) начинается после завершения платформы.
(платформа в виде зеленого диска с зеленым винтом VgrG).Полимеризация хвостовой трубы (кольца Hcp, черные прямоугольники) и оболочки (нити TssBC, красные прямоугольники) начинается после завершения платформы.
https://doi.org/10.1371/journal.pgen.1005545.g007
Пути сборки фагового клина и базовой пластинки регулируются поэтапным добавлением различных субъединиц в строгом порядке [39,44]. Что касается биогенеза T6SS, представленные здесь результаты, а также три недавних исследования [15, 40, 46] подтверждают предположение о том, что сначала собирается мембранный комплекс TssLMJ и что T6SS строится путем иерархического добавления TssK и TssFG.В качестве альтернативы полные базовые пластины могут быть собраны до стыковки с мембранным комплексом (рис. 7). В самом деле, подобная базисной пластинке структура прикреплена к внутренней мембране сетью взаимодействий, включая контакты между TssK и TssL, TssK и TssM, а также TssG и TssM ([40] и это исследование). Можно предположить, что TssK рекрутируется в комплекс TssJLM, а затем взаимодействие между базовой пластинчатой структурой и мембранным комплексом стабилизируется за счет дополнительных контактов между TssM и комплексом TssFG. Этот путь сборки подтверждается записями флуоресцентной микроскопии, демонстрирующими, что TssF не рекрутируется в аппарат в отсутствие TssK или TssM, и что TssK не рекрутируется в аппарат в отсутствие TssM (Fig. 6). Интересно, что в отсутствие TssM, TssF-содержащие комплексы (базовые пластины?) собираются, хотя и на значительно более низких уровнях, указывая на то, что эти комплексы стабилизируются мембранным комплексом. TssM-независимая сборка этих комплексов, содержащих TssF, согласуется с наблюдениями, что (i) мембрана T6SS и комплексы базальная пластинка/хвост имеют различную эволюционную историю [2] и (ii) что мембранный комплекс не требуется для правильной сборки Трубки HCP (рис. 1C).Поразительно, но базовые пластинки фагов демонстрируют 6-кратную симметрию [22,29], и можно предположить, что идентичная симметрия применима к базовым пластинкам T6SS. Однако недавно было показано, что мембранный комплекс T6SS обладает 5-кратной симметрией [15]. Понимание того, как структура 6-кратной симметрии успешно и функционально связывается с док-станцией 5-кратной симметрии, еще предстоит выяснить.
Этот путь сборки подтверждается записями флуоресцентной микроскопии, демонстрирующими, что TssF не рекрутируется в аппарат в отсутствие TssK или TssM, и что TssK не рекрутируется в аппарат в отсутствие TssM (Fig. 6). Интересно, что в отсутствие TssM, TssF-содержащие комплексы (базовые пластины?) собираются, хотя и на значительно более низких уровнях, указывая на то, что эти комплексы стабилизируются мембранным комплексом. TssM-независимая сборка этих комплексов, содержащих TssF, согласуется с наблюдениями, что (i) мембрана T6SS и комплексы базальная пластинка/хвост имеют различную эволюционную историю [2] и (ii) что мембранный комплекс не требуется для правильной сборки Трубки HCP (рис. 1C).Поразительно, но базовые пластинки фагов демонстрируют 6-кратную симметрию [22,29], и можно предположить, что идентичная симметрия применима к базовым пластинкам T6SS. Однако недавно было показано, что мембранный комплекс T6SS обладает 5-кратной симметрией [15]. Понимание того, как структура 6-кратной симметрии успешно и функционально связывается с док-станцией 5-кратной симметрии, еще предстоит выяснить. Как только базовая пластина присоединена к комплексу TssJLM, может продолжаться полимеризация внутренней трубки Hcp/внешней оболочки TssBC (рис. 7).Действительно, исследования взаимодействия показали, что TssF и TssG связаны с Hcp и TssC и могут инициировать удлинение хвоста. Данные, сообщающие о специфической роли TssA во время биогенеза T6SS, будут опубликованы в другом месте (Zoued, Durand et al. ., в процессе подготовки). Пространственно-временное рекрутирование TssE и VgrG во время пути сборки T6SS и их вклад в структуру базовой пластинки T6SS еще не известны и потребуют дальнейших исследований. У сократительных хвостатых бактериофагов базовая пластинка служит сборочной платформой для полимеризации трубки/оболочки и запускает сокращение оболочки путем передачи конформационных изменений от волокон при посадке на клетки-хозяева.Будет важно определить вклад базовой пластинки T6SS в контроль динамики оболочки T6SS при контакте с клетками-жертвами.
Как только базовая пластина присоединена к комплексу TssJLM, может продолжаться полимеризация внутренней трубки Hcp/внешней оболочки TssBC (рис. 7).Действительно, исследования взаимодействия показали, что TssF и TssG связаны с Hcp и TssC и могут инициировать удлинение хвоста. Данные, сообщающие о специфической роли TssA во время биогенеза T6SS, будут опубликованы в другом месте (Zoued, Durand et al. ., в процессе подготовки). Пространственно-временное рекрутирование TssE и VgrG во время пути сборки T6SS и их вклад в структуру базовой пластинки T6SS еще не известны и потребуют дальнейших исследований. У сократительных хвостатых бактериофагов базовая пластинка служит сборочной платформой для полимеризации трубки/оболочки и запускает сокращение оболочки путем передачи конформационных изменений от волокон при посадке на клетки-хозяева.Будет важно определить вклад базовой пластинки T6SS в контроль динамики оболочки T6SS при контакте с клетками-жертвами.
Материалы и методы
Бактериальные штаммы, среда, условия роста и химикаты
Escherichia coli K-12 DH5α использовали для процедур клонирования, W3110 для совместной иммунопреципитации и BTh201 для бактериального двухгибридного анализа. Энтероагрегат E . Для этого исследования использовали coli штамм 17-2.Штаммы обычно выращивали в LB-бульоне при 37°C с аэрацией. Для индукции кластера генов sci-1 T6SS клетки выращивали в среде, индуцирующей Sci-1 (SIM: минимальная среда M9 с добавлением глицерина (0,2%), витамина B1 (1 мкг/мл), казаминокислот (40 мкг /мл), LB (10% v/v)) [49]. Плазмиды и мутации поддерживали добавлением ампициллина (100 мкг/мл для К-12, 200 мкг/мл для EAEC), канамицина (50 мкг/мл для К-12, 50 мкг/мл для хромосомной вставки на EAEC, 100 мкг/мл). мкг/мл для несущих плазмиду EAEC) или хлорамфеникол (40 мкг/мл).L-арабинозу приобретали у Sigma-Aldrich, ангидротетрациклин (АГТ – использовали в концентрации 0,2 мкг/мл на протяжении всего исследования) у IBA. Штаммы, плазмиды и олигонуклеотиды, используемые в этом исследовании, перечислены в таблице S1.
Энтероагрегат E . Для этого исследования использовали coli штамм 17-2.Штаммы обычно выращивали в LB-бульоне при 37°C с аэрацией. Для индукции кластера генов sci-1 T6SS клетки выращивали в среде, индуцирующей Sci-1 (SIM: минимальная среда M9 с добавлением глицерина (0,2%), витамина B1 (1 мкг/мл), казаминокислот (40 мкг /мл), LB (10% v/v)) [49]. Плазмиды и мутации поддерживали добавлением ампициллина (100 мкг/мл для К-12, 200 мкг/мл для EAEC), канамицина (50 мкг/мл для К-12, 50 мкг/мл для хромосомной вставки на EAEC, 100 мкг/мл). мкг/мл для несущих плазмиду EAEC) или хлорамфеникол (40 мкг/мл).L-арабинозу приобретали у Sigma-Aldrich, ангидротетрациклин (АГТ – использовали в концентрации 0,2 мкг/мл на протяжении всего исследования) у IBA. Штаммы, плазмиды и олигонуклеотиды, используемые в этом исследовании, перечислены в таблице S1.
Штаммовая конструкция
Мутантные штаммы
Δ tss были сконструированы с использованием модифицированной одностадийной процедуры инактивации [50] с использованием красной рекомбиназы, экспрессируемой из pKOBEG [51], как описано ранее [52]. Кассету канамицина из pKD4 [50] амплифицировали с олигонуклеотидами, несущими 50-нуклеотидные удлинения, гомологичные участкам, примыкающим к гену-мишени.Продукт полимеразной цепной реакции (ПЦР) очищали на колонке (Promega PCR и Gel Cleanup) и подвергали электропорации. Были восстановлены клоны, устойчивые к канамицину, и вставка кассеты с канамицином в целевом сайте была подтверждена с помощью ПЦР. Затем канамициновую кассету вырезали с использованием плазмиды pCP20 [50] и конечный штамм проверяли с помощью ПЦР. Штамм Δ sci-1 с делецией, который содержит делецию фрагмента tssB-tssE ( i , e , все гены T6SS), конструировали аналогичным образом.Хромосомные флуоресцентные репортерные вставки получали по той же методике с использованием pKD4- gfp , p gfp -KD4 и p mCh -pKD4 в качестве матриц для ПЦР-амплификации.
Кассету канамицина из pKD4 [50] амплифицировали с олигонуклеотидами, несущими 50-нуклеотидные удлинения, гомологичные участкам, примыкающим к гену-мишени.Продукт полимеразной цепной реакции (ПЦР) очищали на колонке (Promega PCR и Gel Cleanup) и подвергали электропорации. Были восстановлены клоны, устойчивые к канамицину, и вставка кассеты с канамицином в целевом сайте была подтверждена с помощью ПЦР. Затем канамициновую кассету вырезали с использованием плазмиды pCP20 [50] и конечный штамм проверяли с помощью ПЦР. Штамм Δ sci-1 с делецией, который содержит делецию фрагмента tssB-tssE ( i , e , все гены T6SS), конструировали аналогичным образом.Хромосомные флуоресцентные репортерные вставки получали по той же методике с использованием pKD4- gfp , p gfp -KD4 и p mCh -pKD4 в качестве матриц для ПЦР-амплификации.
Плазмидные конструкции
ПЦР проводили на термоциклере Biometra с использованием ДНК-полимеразы Pfu Turbo (Stratagene; La Jolla, CA). Индивидуальные олигонуклеотиды были синтезированы компанией Eurogentec. Конструкции pOK-Hcp HA и pUC-Hcp FLAG и их производных были описаны ранее [18,52].pTssF-HA был сконструирован путем встраивания ПЦР-фрагмента Eco RI- Xho I в pMS600, расщепленную теми же ферментами. Все остальные плазмиды были сконструированы методом безрестрикционного клонирования [53]: интересующий ген амплифицировали с олигонуклеотидами, несущими 5′-удлинения, отжиг с вектором-мишенью. Затем продукт первой ПЦР использовали в качестве олигонуклеотидов для второй ПЦР с использованием вектора-мишени в качестве матрицы. Все конструкции были проверены секвенированием ДНК (MWG).
Индивидуальные олигонуклеотиды были синтезированы компанией Eurogentec. Конструкции pOK-Hcp HA и pUC-Hcp FLAG и их производных были описаны ранее [18,52].pTssF-HA был сконструирован путем встраивания ПЦР-фрагмента Eco RI- Xho I в pMS600, расщепленную теми же ферментами. Все остальные плазмиды были сконструированы методом безрестрикционного клонирования [53]: интересующий ген амплифицировали с олигонуклеотидами, несущими 5′-удлинения, отжиг с вектором-мишенью. Затем продукт первой ПЦР использовали в качестве олигонуклеотидов для второй ПЦР с использованием вектора-мишени в качестве матрицы. Все конструкции были проверены секвенированием ДНК (MWG).
Анализ сшивания Hcp
Анализ перекрестного связывания дисульфида in vivo проводили, как описано ранее [18].
Бактериальный двухгибридный анализ
Мы использовали двухгибридный метод на основе аденилатциклазы, используя ранее опубликованные протоколы [40, 54, 55]. Вкратце, пары тестируемых белков сливали с двумя каталитическими доменами Т18 и Т25 аденилатциклазы Bordetella . После совместной трансформации штамма BTh201 двумя плазмидами, продуцирующими слитые белки, планшеты инкубировали при 30°С в течение 2 дней.Независимыми колониями инокулировали 600 мкл среды LB с добавлением ампициллина, канамицина и 0,5 мМ изопропилтиогалактозида (ИПТГ). Клетки выращивали при 30°C в течение ночи и высевали на чашки с агаром LB с добавлением ампициллина, канамицина, IPTG (0,2 мМ) и 5-бром-4-хлор-3-индолил-D-галактопиранозида (X-Gal), хромогенного субстрата. -галактозидазы.
Вкратце, пары тестируемых белков сливали с двумя каталитическими доменами Т18 и Т25 аденилатциклазы Bordetella . После совместной трансформации штамма BTh201 двумя плазмидами, продуцирующими слитые белки, планшеты инкубировали при 30°С в течение 2 дней.Независимыми колониями инокулировали 600 мкл среды LB с добавлением ампициллина, канамицина и 0,5 мМ изопропилтиогалактозида (ИПТГ). Клетки выращивали при 30°C в течение ночи и высевали на чашки с агаром LB с добавлением ампициллина, канамицина, IPTG (0,2 мМ) и 5-бром-4-хлор-3-индолил-D-галактопиранозида (X-Gal), хромогенного субстрата. -галактозидазы.
Ко-иммунопреципитация
10 11 экспоненциально растущие клетки, продуцирующие представляющие интерес белки, собирали и ресуспендировали в 20 мМ Tris-HCl (pH 8.0), NaCl 100 мМ с добавлением ингибиторов протеазы (Complete, Roche) и разделены тремя пассажами во Френч-прессе (1000 фунтов на кв. дюйм). Общий клеточный экстракт подвергали ультрацентрифугированию в течение 45 мин при 20 000 × г для удаления нерастворимого материала. Затем супернатанты инкубировали в течение ночи при 4°C с аффинными шариками против FLAG M2 (Sigma Aldrich) или с шариками с протеином G-агарозой (Roche), связанными с антителом против VSVG. Затем гранулы трижды промывали Трис-HCl 20 мМ (рН 8,0), NaCl 100 мМ.Общий экстракт и иммунопреципитированный материал ресуспендировали в загрузочном буфере Лэммли перед анализом с помощью SDS-PAGE и иммуноблоттинга. Для экспериментов по восстановлению клеточные лизаты перемешивали в течение 30 мин. при 28°C до иммунного преципитации.
Затем супернатанты инкубировали в течение ночи при 4°C с аффинными шариками против FLAG M2 (Sigma Aldrich) или с шариками с протеином G-агарозой (Roche), связанными с антителом против VSVG. Затем гранулы трижды промывали Трис-HCl 20 мМ (рН 8,0), NaCl 100 мМ.Общий экстракт и иммунопреципитированный материал ресуспендировали в загрузочном буфере Лэммли перед анализом с помощью SDS-PAGE и иммуноблоттинга. Для экспериментов по восстановлению клеточные лизаты перемешивали в течение 30 мин. при 28°C до иммунного преципитации.
Анализ высвобождения Hcp, градиенты плотности фракционирования и седиментации
Анализ высвобождения
Hcp, фракционирование, дифференциальную солюбилизацию SLS, прерывистое осаждение, градиенты сахарозы и измерения активности NADH-оксидазы выполняли, как описано ранее [13].
Покадровая флуоресцентная микроскопия
Ночные культуры энтероагрегантов E . Штаммы производных coli 17–2 разбавляли 1:100 в среде SIM и выращивали в течение 6 часов до OD 600 нм ~ 1,0 для максимизации экспрессии кластера генов sci-1 T6SS, который активируется в железе- истощенных условиях [49]. Клетки промывали в фосфатно-солевом буфере (PBS), ресуспендировали в PBS до OD 600 нм ~ 50 и наносили на тонкий слой 1.5% агарозы в PBS и накрыли покровным стеклом. Записи микроскопии и цифровая обработка изображений выполнялись, как описано ранее [9,15,18,40]. Для статистического анализа флуоресцентные очаги обнаруживались автоматически. Во-первых, шум и фон были уменьшены с помощью плагина «Subtract Background» (20 пикселей Rolling Ball) от Fiji [56]. Очаги sfGFP были автоматически обнаружены с помощью простой обработки изображения: (1) создать маску клеточной поверхности и расширить (2) обнаружить отдельные клетки с помощью плагина «Анализ частиц» Фиджи (3) очаги sfGFP были идентифицированы с помощью «Найти Максима» на Фиджи [56].Чтобы избежать ложных срабатываний, каждое событие в исходных необработанных данных контролировалось вручную. Представление числа очагов на клетку в виде коробочек и усов было выполнено с помощью программного обеспечения R. Для отслеживания с субпиксельным разрешением флуоресцентные очаги обнаруживались с использованием алгоритма обнаружения максимумов локального и субпиксельного разрешения и отслеживались с течением времени с помощью специально разработанного плагина для ImageJ [56].
Клетки промывали в фосфатно-солевом буфере (PBS), ресуспендировали в PBS до OD 600 нм ~ 50 и наносили на тонкий слой 1.5% агарозы в PBS и накрыли покровным стеклом. Записи микроскопии и цифровая обработка изображений выполнялись, как описано ранее [9,15,18,40]. Для статистического анализа флуоресцентные очаги обнаруживались автоматически. Во-первых, шум и фон были уменьшены с помощью плагина «Subtract Background» (20 пикселей Rolling Ball) от Fiji [56]. Очаги sfGFP были автоматически обнаружены с помощью простой обработки изображения: (1) создать маску клеточной поверхности и расширить (2) обнаружить отдельные клетки с помощью плагина «Анализ частиц» Фиджи (3) очаги sfGFP были идентифицированы с помощью «Найти Максима» на Фиджи [56].Чтобы избежать ложных срабатываний, каждое событие в исходных необработанных данных контролировалось вручную. Представление числа очагов на клетку в виде коробочек и усов было выполнено с помощью программного обеспечения R. Для отслеживания с субпиксельным разрешением флуоресцентные очаги обнаруживались с использованием алгоритма обнаружения максимумов локального и субпиксельного разрешения и отслеживались с течением времени с помощью специально разработанного плагина для ImageJ [56]. Координаты x и y были получены для каждого флуоресцентного фокуса на каждом кадре. Среднеквадратичное смещение рассчитывали как расстояние от фокусов до их положения в точке t 0 в каждый момент времени с использованием программного обеспечения R и наносили на график во времени.Для каждого испытанного штамма рассчитывали среднеквадратичное смещение не менее десяти отдельных траекторий фокусировки. Кимограммы были получены после вычитания и секционирования фоновой флуоресценции с помощью плагина Kymoreslicewide под Fiji [56].
Координаты x и y были получены для каждого флуоресцентного фокуса на каждом кадре. Среднеквадратичное смещение рассчитывали как расстояние от фокусов до их положения в точке t 0 в каждый момент времени с использованием программного обеспечения R и наносили на график во времени.Для каждого испытанного штамма рассчитывали среднеквадратичное смещение не менее десяти отдельных траекторий фокусировки. Кимограммы были получены после вычитания и секционирования фоновой флуоресценции с помощью плагина Kymoreslicewide под Fiji [56].
Стабильность стационарных уровней белка
Стабильность белка оценивали, как описано ранее [57]. Экспоненциально растущие клетки, продуцирующие TssF, TssG или как TssF, так и TssG, обрабатывали хлорамфениколом (40 мкг/мл) и спектиномицином (200 мкг/мл).Эквивалентные образцы OD собирали через 0, 5, 15, 30, 60, 120, 240, 480 и 960 минут после остановки синтеза белка, ресуспендировали в загрузочном буфере перед анализом с помощью SDS-PAGE и вестерн-блоттинга. Плотность бактерий (OD 600 нм ) измеряли на протяжении всего эксперимента, чтобы убедиться в отсутствии роста.
Плотность бактерий (OD 600 нм ) измеряли на протяжении всего эксперимента, чтобы убедиться в отсутствии роста.
Разное
Белки, суспендированные в загрузочном буфере, подвергали SDS-PAGE. Для выявления иммуноокрашиванием белки переносили на нитроцеллюлозные мембраны, а иммуноблоты зондировали первичными антителами и козьими вторичными антителами, связанными со щелочной фосфатазой, и проявляли в щелочном буфере в присутствии 5-бром-4-хлор-3-индолилфосфата и нитросинего. тетразолий.Поликлональные антитела анти-TolA, -TolB, -Pal и -OmpA взяты из нашей лабораторной коллекции. Анти-FLAG (Sigma-Aldrich), анти-VSV-G (Sigma-Aldrich), анти-HA (Roche), анти-EFTu (Hycult Biotech) и антикроличья, мышиная или крысиная щелочная фосфатаза, конъюгированная с козьим вторичным антитела (Beckman Coulter) были приобретены в соответствии с указаниями и использованы в соответствии с рекомендациями производителя.
Вспомогательная информация
S1 Рис. Белки TssF и TssG необходимы для секреции типа VI.

Влияние мутаций tssF и tssG на образование оболочки T6SS (A) и высвобождение белка Hcp (B).(A) Покадровые записи флуоресценции клеток WT, tssF или tssG , несущих слияние хромосом tssB-mCherry в исходном локусе. Отдельные изображения делались каждые 30 секунд. События сборки и сжатия/разборки обозначены черным и белым треугольниками соответственно. Шкала баров составляет 1 м. (B) Высвобождение Hcp FLAG оценивали путем разделения фракций целых клеток (C) и супернатантов (S) от WT, tssF или tssG и дополненных tssF или tssG или цсГ + ) культур.В общей сложности 2×10 8 клеток и ТХУ-преципитированный материал супернатанта из 5×10 8 клеток наносили на SDS-PAGE с 12,5%-ным акриламидом и подвергали иммунодетекции с использованием моноклонального антитела против FLAG (нижняя панель). ) и поликлональные антитела против TolB (контроль целостности клеток; верхняя панель).
https://doi.org/10.1371/journal.pgen.1005545.s002
(TIF)
S2 Фиг. ClustalW выравнивание TssF и TssG с белком NP_7555275 из
E . кишечная палочка CFT073.
TssF и N-концевая область NP_7555275 имеют 58% идентичности и 75% сходства. TssG и С-концевая область NP_7555275 имеют 53% идентичности и 82% сходства. Область, соответствующая слиянию, обрамлена.
https://doi.org/10.1371/journal.pgen.1005545.s003
(TIF)
S3 Рис. Статистический анализ динамики и поведения флуоресцентных субъединиц.
Статистические анализы локализации sfGFP ЦсФ (А), ЦсК sfGFP (F) или sfGFP ЦсМ (G) у указанных штаммов.Показаны графики измеренного количества sfGFP TssF, TssK sfGFP или sfGFP TssM на клетку для каждого штамма с нижними и верхними границами прямоугольников, соответствующими 25% и 75% процентили соответственно. Черная жирная горизонтальная полоса представляет средние значения для каждого штамма, а усы представляют 10% и 90% процентили. Выбросы показаны незаштрихованными кружками. n указывает количество проанализированных клеток на штамм.(Б) Очаги sfGFP TssF и TssK sfGFP стабильны и статичны. Среднеквадратичное смещение (в пикселях) кластеров sfGFP TssF в клетках WT (синий график) или Δ tssBC клеток (красный график) и кластеров TssKsfGFP в клетках WT (черный график) измеряли путем субпиксельного отслеживания флуоресцентных фокусов и график по времени (в минутах). (C) Кластеры sfGFP TssF собираются до оболочек TssBC. Кинетика появления кластеров sfGFP TssF (зеленая линия) и динамика оболочек TssB mCh (столбцы; оранжевый: удлинение, синий: удлинение; фиолетовый: сжатие/разборка) в зависимости от времени (в минутах).(D) sfGFP TssF остается в основании чехла при растяжении. Кимографический анализ показывает положение sfGFP TssF (зеленый) и TssB mCh (красный) внутри клетки в зависимости от времени.
Выбросы показаны незаштрихованными кружками. n указывает количество проанализированных клеток на штамм.(Б) Очаги sfGFP TssF и TssK sfGFP стабильны и статичны. Среднеквадратичное смещение (в пикселях) кластеров sfGFP TssF в клетках WT (синий график) или Δ tssBC клеток (красный график) и кластеров TssKsfGFP в клетках WT (черный график) измеряли путем субпиксельного отслеживания флуоресцентных фокусов и график по времени (в минутах). (C) Кластеры sfGFP TssF собираются до оболочек TssBC. Кинетика появления кластеров sfGFP TssF (зеленая линия) и динамика оболочек TssB mCh (столбцы; оранжевый: удлинение, синий: удлинение; фиолетовый: сжатие/разборка) в зависимости от времени (в минутах).(D) sfGFP TssF остается в основании чехла при растяжении. Кимографический анализ показывает положение sfGFP TssF (зеленый) и TssB mCh (красный) внутри клетки в зависимости от времени. (E) Процент чехлов (обозначенных как удлиненные структуры TssB mCh ) с базальными кластерами sfGFP TssF (обозначенных фокусами, меченными GFP) (пунктирная полоса) в штамме, продуцирующем как sfGFP TssF, так и TssB mCh . n указывает количество проанализированных клеток.
(E) Процент чехлов (обозначенных как удлиненные структуры TssB mCh ) с базальными кластерами sfGFP TssF (обозначенных фокусами, меченными GFP) (пунктирная полоса) в штамме, продуцирующем как sfGFP TssF, так и TssB mCh . n указывает количество проанализированных клеток.
https://doi.org/10.1371/journal.pgen.1005545.s004
(TIFF)
S4 Рис. Сравнение взаимодействия субъединиц T6SS и T4 бактериофага.
Схематическое представление известных взаимодействий между выбранными компонентами бактериофага T4 (вверху) или между компонентами T6SS (внизу). Белки с общей последовательностью или структурной гомологией обозначены одним цветом. Компоненты клина бактериофага T4 указаны в синей рамке, а мембранный комплекс T6SS (MC), комплекс базовой пластины (BC) и хвостовой комплекс (TC) выделены серым, зеленым и красным цветом соответственно.
https://doi.org/10.1371/journal.pgen.1005545.s005
(TIF)
Благодарности
Мы посвящаем эту работу Арлетт Дарфёй-Мишо в память о ней [58]. Мы благодарим членов исследовательских групп Cascales, Cambillau, Lloubes, Sturgis и Bouveret за полезные обсуждения, Emmanuelle Bouveret за бактериальные двухгибридные штаммы, векторы, протоколы и полезные обсуждения, Tâm Mignot за анализы кимографа и обсуждения флуоресцентной микроскопии, Laure Journet , Erwan Gueguen, Eric Durand, Roland Lloubes, Mireille Ansaldi, Bérengère Ize и Brigitte Meunier за плодотворные обсуждения и поддержку, Marthe Gavioli, Olivier Uderso, Isabelle Bringer и Annick Brun за техническую помощь и Thomas Toquette-Schoepp за поддержку.
Мы благодарим членов исследовательских групп Cascales, Cambillau, Lloubes, Sturgis и Bouveret за полезные обсуждения, Emmanuelle Bouveret за бактериальные двухгибридные штаммы, векторы, протоколы и полезные обсуждения, Tâm Mignot за анализы кимографа и обсуждения флуоресцентной микроскопии, Laure Journet , Erwan Gueguen, Eric Durand, Roland Lloubes, Mireille Ansaldi, Bérengère Ize и Brigitte Meunier за плодотворные обсуждения и поддержку, Marthe Gavioli, Olivier Uderso, Isabelle Bringer и Annick Brun за техническую помощь и Thomas Toquette-Schoepp за поддержку.
Авторские взносы
Идея и разработка экспериментов: YRB AZ EC. Выполнены опыты: YRB AZ FB BD. Проанализированы данные: YRB AZ FB EC. Предоставленные реагенты/материалы/инструменты для анализа: FB EC. Написал статью: YRB AZ EC.
Каталожные номера
- 1.
Рассел А.Б., Петерсон С.Б., Мугус Д.Д. (2014) Эффекторы системы секреции типа VI: целенаправленные яды. Nat Rev Microbiol. 12: 137–48. пмид:24384601
пмид:24384601 - 2.
Boyer F, Fichant G, Berthod J, Vandenbrouck Y, Attree I (2009) Анализ системы секреции бактерий типа VI с помощью полногеномного анализа in silico: что можно узнать из доступных микробных геномных ресурсов? Геномика BMC.10:104. пмид:19284603 - 3.
Coulthurst SJ (2013) Система секреции типа VI — широко распространенная и универсальная система нацеливания на клетки. Рез микробиол. 164: 640–54. пмид:23542428 - 4.
Borgeaud S, Metzger LC, Scrignari T, Blokesch M (2015) Система секреции Vibrio cholerae типа VI способствует горизонтальному переносу генов. Наука. 347:63–7. пмид:25554784 - 5.
Benz J, Meinhart A (2014)Антибактериальные эффекторные/иммунные системы: это лишь верхушка айсберга.Curr Opin Microbiol. 17: 1–10. пмид:24581686 - 6.
Durand E, Cambillau C, Cascales E, Journet L (2014) VgrG, Tae, Tle и другие: универсальный арсенал эффекторов секреции типа VI. Тенденции микробиол. 22: 498–507. пмид:25042941
22: 498–507. пмид:25042941 - 7.
LeRoux M, De Leon JA, Kuwada NJ, Russell AB, Pinto-Santini D, et al. (2012)Количественная характеристика бактериальных взаимодействий с отдельными клетками показывает, что секреция типа VI является палкой о двух концах. Proc Natl Acad Sci USA.109: 19804–9. пмид:23150540 - 8.
Basler M, Ho BT, Mekalanos JJ (2013)Око за око: контратака системы секреции типа VI во время взаимодействия бактериальных клеток. Клетка. 152: 884–94. пмид:23415234 - 9.
Brunet YR, Espinosa L, Harchouni S, Mignot T, Cascales E (2013) Визуализация уничтожения бактерий, опосредованного секрецией VI типа. Cell Rep. 3: 36–41. пмид:23291094 - 10.
Cascales E, Cambillau C (2012)Структурная биология систем секреции типа VI.Philos Trans R Soc Lond B Biol Sci. 367: 1102–11. пмид:22411981 - 11.
Хо Б.Т., Донг Т.Г., Мекаланос Дж.Дж. (2014) Взгляд на убийство: бактериальная система секреции типа VI. Клеточный микроб-хозяин. 15: 9–21. пмид:24332978
Клеточный микроб-хозяин. 15: 9–21. пмид:24332978 - 12.
Зуэд А., Брюнет Ю.Р., Дюран Э., Аштген М.С., Логгер Л. и соавт. (2014)Архитектура и сборка системы секреции типа VI. Биохим Биофиз Акта. 1843: 1664–73. пмид:24681160 - 13.
Аштген М.С., Гавиоли М., Дессен А., Ллубес Р., Каскалес Э. (2010)Белок SciZ закрепляет энтероагрегативную систему секреции Escherichia coli типа VI на клеточной стенке.Мол микробиол. 75:886–99. пмид:20487285 - 14.
Felisberto-Rodrigues C, Durand E, Aschtgen MS, Blangy S, Ortiz-Lombardia M, et al. (2011) На пути к структурному пониманию систем секреции бактерий типа VI: характеристика комплекса TssJ-TssM патовара Escherichia coli. PLoS Патог. 7: e1002386. пмид:22102820 - 15.
Дюран Э., Нгуен В.С., Зуэд А., Логгер Л., Пехау-Арноде Г. и др. (2015)Биогенез и структура основного комплекса секреторной мембраны типа VI.Природа. 523: 555–560. пмид:26200339 - 16.
Лейман П. Г., Баслер М., Рамагопал Ю.А., Бонанно Дж.Б., Саудер Дж.М. и др. (2009) Аппарат секреции типа VI и белковые комплексы, связанные с фаговым хвостом, имеют общее эволюционное происхождение. Proc Natl Acad Sci USA. 106: 4154–9. пмид:19251641
Г., Баслер М., Рамагопал Ю.А., Бонанно Дж.Б., Саудер Дж.М. и др. (2009) Аппарат секреции типа VI и белковые комплексы, связанные с фаговым хвостом, имеют общее эволюционное происхождение. Proc Natl Acad Sci USA. 106: 4154–9. пмид:19251641 - 17.
Баллистер Э.Р., Лай А.Х., Цукерманн Р.Н., Ченг Ю., Мугус Д.Д. (2008) Самосборка адаптируемых нанотрубок in vitro из простого строительного блока белка. Proc Natl Acad Sci USA.105:3733–8. пмид:18310321 - 18.
Brunet YR, Hénin J, Celia H, Cascales E (2014) Секреция типа VI и хвостовые трубки бактериофагов имеют общий путь сборки. EMBO Rep. 15: 315–21. пмид:24488256 - 19.
Shneider MM, Buth SA, Ho BT, Basler M, Mekalanos JJ, et al. (2013) Белки с повторами PAAR обостряют и диверсифицируют спайк системы секреции типа VI. Природа. 500: 350–3. пмид:23925114 - 20.
Канамару С. (2009)Структурное сходство хвостатых фагов и систем секреции патогенных бактерий.Proc Natl Acad Sci USA. 106: 4067–8. пмид:19276114
106: 4067–8. пмид:19276114 - 21.
Бенеманн Г., Пьетросюк А., Могк А. (2010) Трубочки и пончики: история секреции типа VI. Мол микробиол. 76:815–21. пмид:20444095 - 22.
Лейман П.Г., Шнейдер М.М. (2012) Сократительные хвостовые аппараты бактериофагов. Adv Exp Med Biol. 726: 93–114. пмид:22297511 - 23.
Кубе С., Капитеин Н., Зимняк Т., Херцог Ф., Могк А. и др. (2014)Структура секреторного комплекса VipA/B типа VI предполагает механизм рециркуляции, специфичный для состояния сокращения.Ячейка 8: 20–30. пмид:24953649 - 24.
Клеменс Д.Л., Гэ П., Ли Б.Я., Хорвиц М.А., Чжоу Чж. (2015) Атомная структура T6SS показывает чересстрочный массив, необходимый для функционирования. Клетка. 160: 940–951. пмид:25723168 - 25.
Кудряшев М., Ван Р.Ю., Бракманн М., Шерер С., Майер Т. и соавт. (2015)Структура сократительной оболочки системы секреции VI типа. Клетка. 160: 952–962. пмид:25723169 - 26.
Basler M, Pilhofer M, Henderson GP, Jensen GJ, Mekalanos JJ (2012) Секреция типа VI требует динамической сократительной структуры, подобной хвосту фага. Природа. 483: 182–6. пмид:22367545
Природа. 483: 182–6. пмид:22367545 - 27.
Капитейн Н., Бенеманн Г., Петросюк А., Сейффер Ф., Хауссер И. и др. (2013). ClpV рециркулирует канальцы VipA/VipB и предотвращает образование непродуктивных канальцев, чтобы обеспечить эффективную секрецию белка типа VI. Мол микробиол. 87: 1013–28. пмид:23289512 - 28.
Капитеин Н., Могк А. (2013)Смертельные шприцы: активность системы секреции типа VI в патогенности и межбактериальной конкуренции. Curr Opin Microbiol. 16: 52–8. пмид:232 - 29.Костюченко В.А., Лейман П.Г., Чипман П.Р., Канамару С., ван Раай М.Дж. и др. (2003) Трехмерная структура базовой пластинки бактериофага Т4. Nat Struct Biol. 10: 688–93. пмид:12923574
- 30.
Костюченко В.А., Чипман П.Р., Лейман П.Г., Арисака Ф., Месянжинов В.В., и др. (2005)Структура хвоста бактериофага Т4 и механизм его сокращения. Nat Struct Mol Biol. 12: 810–3. пмид:16116440 - 31.
Лейман П.Г., Арисака Ф., ван Раай М. Дж., Костюченко В.А., Аксюк А.А., и соавт.(2010)Морфогенез хвоста Т4 и хвостовых волокон. Вирол Дж. 7: 355. pmid:21129200
Дж., Костюченко В.А., Аксюк А.А., и соавт.(2010)Морфогенез хвоста Т4 и хвостовых волокон. Вирол Дж. 7: 355. pmid:21129200 - 32.
Хаггард-Льюнгквист Э., Якобсен Э., Ришовд С., Сикс Э.В., Нильссен О. и др. (1995) Бактериофаг P2: гены, участвующие в сборке базовой пластины. Вирусология. 213: 109–21. пмид:7483254 - 33.
Хаузер Р., Блаше С., Докланд Т., Хаггорд-Льюнгквист Э., фон Брунн А. и др. (2012) Белково-белковые взаимодействия бактериофагов. Adv вирус Res. 83: 219–98. пмид:22748812 - 34.
King J (1968)Сборка хвоста бактериофага Т4.Дж Мол Биол. 32: 231–62. пмид:4868421 - 35.
Bingle LE, Bailey CM, Pallen MJ (2008) Секреция типа VI: руководство для начинающих. Curr Opin Microbiol. 11: 3–8. пмид:18289922 - 36.
Cascales E (2008) Набор инструментов для секреции типа VI. EMBO Rep. 9: 735–41. пмид:18617888 - 37.
Silverman JM, Brunet YR, Cascales E, Mougous JD (2012)Структура и регуляция системы секреции типа VI. Анну Рев Микробиол. 66: 453–72. пмид:22746332
Анну Рев Микробиол. 66: 453–72. пмид:22746332 - 38.Lossi NS, Dajani R, Freemont P, Filloux A (2011) Структурно-функциональный анализ HsiF, gp25-подобного компонента системы секреции типа VI, у Pseudomonas aeruginosa. Микробиология. 157: 3292–305. пмид: 21873404
- 39.
Яп М.Л., Мио К., Лейман П.Г., Канамару С., Арисака Ф. (2010)Клинья базовой пластины бактериофага Т4 спонтанно собираются в структуру, подобную базовой пластине без выступов, in vitro. Дж Мол Биол. 395: 349–60. пмид:19896486 - 40.
Zoued A, Durand E, Bebeacua C, Brunet YR, Douzi B, et al.(2013) TssK представляет собой тримерный цитоплазматический белок, взаимодействующий с компонентами как фагоподобных, так и мембранно-якорных комплексов системы секреции VI типа. Дж. Биол. Хим. 288: 27031–41. пмид:23921384 - 41.
Сёдинг Дж., Бигерт А., Лупас А.Н. (2005) Интерактивный сервер HHpred для обнаружения гомологии белков и прогнозирования структуры. Нуклеиновые Кислоты Res. 33: W244–8. пмид:15980461
33: W244–8. пмид:15980461 - 42.
Ямасита Э., Накагава А., Такахаши Дж., Цунода К., Ямада С. и др. (2011)Связывающий хозяин домен хвостового шипа фага P2 обнаруживает тримерную железосвязывающую структуру.Acta Crystallogr Sect F Struct Biol Cryst Commun. 67: 837–41. пмид:21821878 - 43.
Kikuchi Y, King J (1975)Генетический контроль морфогенеза базовой пластинки бактериофага T4. II. Мутанты не могут сформировать центральную часть базовой пластины. Дж Мол Биол. 99: 673–94. пмид:765482 - 44.
Kikuchi Y, King J (1975)Генетический контроль морфогенеза базовой пластинки бактериофага T4. III. Формирование центральной пробки и общего пути сборки. Дж Мол Биол. 99: 695–716. пмид:765483 - 45.Watts NR, Coombs DH (1989) Анализ ближних контактов в клиньях бактериофага T4 и базовых пластинах без выступов с использованием расщепляемого химического сшивающего агента. Дж Вирол. 63: 2427–36. пмид:2724408
- 46.
English G, Byron O, Cianfanelli FR, Prescott AR, Coulthurst SJ (2014) Биохимический анализ TssK, основного компонента бактериальной системы секреции типа VI, выявляет различные олигомерные состояния TssK и идентифицирует субкомплекс TssK-TssFG. Биохим Дж. 461: 291–304.пмид:24779861
Биохим Дж. 461: 291–304.пмид:24779861 - 47.
Sarris PF, Ladoukakis ED, Panopoulos NJ, Scoulica EV (2014)Элемент, происходящий из фагового хвоста, с широким распространением среди обоих прокариотических доменов: сравнительное геномное и филогенетическое исследование. Геном Биол Эвол. 6: 1739–1747. пмид:25015235 - 48.
Аксюк А.А., Лейман П.Г., Шнейдер М.М., Месянжинов В.В., Россманн М.Г. (2009) Структура продукта гена 6 бактериофага Т4, шарнирного стержня базовой пластинки. Структура. 17: 800–8. пмид:19523898 - 49.Brunet YR, Bernard CS, Gavioli M, Lloubès R, Cascales E (2011)Эпигенетический переключатель, включающий перекрывающееся метилирование меха и ДНК, оптимизирует экспрессию кластера генов секреции VI типа. Генетика PLoS. 7:e1002205. пмид:21829382
- 50.
Даценко К.А., Ваннер Б.Л. (2000) Одностадийная инактивация хромосомных генов у Escherichia coli K-12 с использованием продуктов ПЦР. Proc Natl Acad Sci USA. 97: 6640–5. пмид:10829079
пмид:10829079 - 51.
Chaveroche MK, Ghigo JM, d’Enfert C (2000)Быстрый метод эффективной замены генов в нитчатом грибе Aspergillus nidulans.Нуклеиновые Кислоты Res. 28: Е97. пмид:11071951 - 52.
Aschtgen MS, Bernard CS, De Bentzmann S, Lloubès R, Cascales E (2008) SciN представляет собой липопротеин внешней мембраны, необходимый для секреции типа VI в энтероагрегативной кишечной палочке. J Бактериол. 190: 7523–31. пмид:18805985 - 53.
van den Ent F, Löwe J (2006) RF-клонирование: метод без ограничений для вставки генов-мишеней в плазмиды. J Biochem Биофизические методы. 67: 67–74. пмид:16480772 - 54.Каримова Г., Пиду Дж., Ульманн А., Ладан Д. (1998) Бактериальная двухгибридная система, основанная на восстановленном пути передачи сигнала. Proc Natl Acad Sci USA. 95: 5752-6. пмид:9576956
- 55.
Battesti A, Bouveret E (2012)Бактериальная двухгибридная система, основанная на восстановлении аденилатциклазы в Escherichia coli. Методы. 58: 325–34. пмид:22841567
Методы. 58: 325–34. пмид:22841567 - 56.
Schindelin J, Arganda-Carreras I, Frize E, Kaynig V, Longair M, et al. (2012) Фиджи: платформа с открытым исходным кодом для анализа биологических изображений.Нат Методы. 9: 676–682. пмид:22743772 - 57.
Cascales E, Lloubès R, Sturgis JN (2001) Белки TolQ-TolR активизируют TolA и обладают гомологией с жгутиковыми моторными белками MotA-MotB. Мол микробиол. 42: 795–807. пмид:11722743 - 58.
Райш Дж., Сивиньон А., Шассинг Б., Лапакет П., Микель С. и др. (2014) Арлетт Дарфей-Мишо: исследователь, лектор, лидер, наставник и друг. Гастроэнтерология 147: 943–944. пмид:25438798 - 59.
Гальперин М.Ю., Макарова К.С., Вольф Ю.И., Кунин Е.В. (2015)Расширенный охват микробного генома и улучшенная аннотация семейства белков в базе данных COG.Нуклеиновые Кислоты Res. 43: Д261–9. пмид: 25428365
Конструкции FabriTec
350 Калмус Драйв
Коста-Меса, Калифорния 92626
Тел. : (714) 427-6980
: (714) 427-6980
Бесплатный номер: (877) 887-4233
Факс: (714) 427-6983
Электронная почта: [email protected]
Веб-сайт: http://www.fabritecstructures.com
Понимание жизнеспособных форм и форм имеет важное значение для проектирования натяжения.
структуры.Конфигурация опорного элемента и кривизна тканевого пролета
между опорами определяют основную форму. Наиболее распространенные формы напряжения
тканевые конструкции включают:
- Поддерживаемая мачта
- Точка поддерживается
- Edge поддерживает
- Арка и рама поддерживаются
конструкции состоят из одной или нескольких вершин, поддерживаемых центральной
столбы. Компрессионное кольцо или кольцо «тюка» соединяет ткань с
центральная опора мачты и облегчает монтаж и натяжение ткани.Конструкции
создают чистый пролет без центральной мачты. Внешний вид
каркас или ряд периферийных мачт поддерживает тканевые козырьки.
Конструкции
— еще один подход к созданию четкой пролетной конструкции.
Ткань поддерживается по периметру параллельными мачтами с тканью.
чередование высоких и низких точек. Мачты удерживаются в положении с помощью
кабели или стяжки.
Структуры
также избегают внутренних колонн в дополнение к введению
изогнутые элементы сжатия в качестве основного опорного элемента.Для боковой устойчивости
в арочных системах могут использоваться «поперечные арки» или диагональные связи.
использоваться.
Конструкции
используются, чтобы избежать внутренних опор и массивных
опоры. Ткань крепится к структурному каркасу и форме конструкции
определяется формой рамы. Основные структурные компоненты несут
большая часть сил внутри системы, так как ткань используется исключительно в качестве облицовки.
После разработки проекта компьютерная модель обеспечивает необходимые
геометрия и нагрузки для начала проектирования мембраны, фитингов и основных компонентов. Производство и детали следующих компонентов выполняются по специальному заказу.
Производство и детали следующих компонентов выполняются по специальному заказу.
стандарты строительных норм:
Опорная плита образует соединение между структурой натяжной мембраны
и земля, стена, здание или соседняя структурная система. Базовая плита
обычно приваривается к нижней части сжимаемого элемента или отделяется от
мачты и соединены с мачтой штыревым соединением.
Для большинства конструкций с натяжной мембраной требуется сжимающий элемент (мачта или арка).
сформировать сложную форму.На мачте обычно используется сварная «укладка».
или «распорки» для поддержки мембраны, троса или других конструктивных элементов.
Мембранные пластины обеспечивают «связь» между мембраной и конструкционным
мачты. «Кольца для тюков» используются в верхней части конструкций конической формы.
а по периметру установлены мембранные плиты для приема мембраны
контактные кабели и оборудование для штыревого соединения.
«Катенарии» формируются по периметру ткани, простирающейся от
мачта к мачте. Каждая мачта по периметру требует соединения с большим моментом
Каждая мачта по периметру требует соединения с большим моментом
или ряд кабельных стяжек, чтобы выдерживать нагрузки. Устанавливаются контактные кабели
внутри кармана в ткани и обычно заканчиваются резьбовым концом
шлейф, соединенный с пластинами мембраны. Стяжные кабели обычно крепятся
к скобам на вершине мачты и соединенным с анкерами, установленными в земле.
Мембрана образует ограждение конструкции и может быть изготовлена
способов.Его можно сшить, склеить, сварить электронным способом и/или запаять. Там
доступны различные стили швов, нахлесты и усиления.
Окончательная геометрия изготовления для всех аспектов структуры натяжной мембраны
должны быть получены из одной и той же компьютерной модели. Выкройки, созданные с помощью компьютера
сгенерированное программное обеспечение создает развернутые панели, которые представляют мембрану в ее
напряженное состояние.
Оборудование
Tension Membrane Structure состоит из деталей, изготовленных для гонок на яхтах,
мостостроение, такелажная и альпинистская промышленность. Скобы, талрепы,
Скобы, талрепы,
spelter-сокеты — это лишь некоторые из доступных аппаратных средств. Самый напряженный
тканевые конструкции состоят из тросов с резьбовыми наконечниками. Мембранные пластины
обычно крепятся к основным стальным компонентам с помощью скоб и/или талрепов.
Фурнитура бывает из нержавеющей стали, оцинкованной и с индивидуальной отделкой.
Зажимные пластины обычно используются для обеспечения водонепроницаемого уплотнения вдоль желоба,
балка или соседнее здание.В качестве материала чаще всего используется алюминий или сталь.
Зажим может быть экструдирован или отлит, чтобы иметь четкий профиль.
После того, как форма и ее границы установлены, направление переплетения и
расположение швов решено. Направление переплетения (основа и уток) определяется
первичная кривизна конструкции. Тканые ткани обычно натягивают в
направление утка (или заполнения). Схема шва для выкройки определяется как
утка и основы переплетения и по внешнему виду.
Проектирование натяжной конструкции — это союз инженерии и архитектуры.
полагается на «эстетику инженера», чтобы определить размер
и формы структурных элементов. Дизайнер должен учитывать
различные требования, предъявляемые к инженерным деталям при строительстве
натяжной мембранной конструкции и на протяжении всего срока ее службы.
Следующим шагом в процессе проектирования является анализ реакции конструкции.
к нагрузкам, включая стационарные и временные нагрузки (снег, ветер и т.). Опытный
специализированная фирма должна провести структурный анализ предлагаемой конструкции.
FabriTec Structures — одна из немногих проектно-строительных фирм в стране, которая предоставляет
услуги по проектированию и изготовлению с возможностью «нахождения формы».
Строительная документация включает в себя проектирование и деталировку конструктивных элементов;
выбор и спецификация материала ткани; подробности и расписание
кабели и оборудование; и «раскрой шаблонов» для изготовления. Инжиниринг
Инжиниринг
Сначала создаются чертежи, и на их основе выполняются структурные расчеты.
После утверждения производятся рабочие чертежи и выполняется выкройка ткани.
Специализированный опыт в изготовлении и монтаже натяжных
тканевых конструкций является важным фактором при выборе фирмы для этого
работай. Включите специалистов FabriTec Structures в свою проектную группу, чтобы поделиться опытом,
координация и внимание к деталям, что приводит к успешному проекту, на
времени и в рамках бюджета.
Модернизация перил на перестройке палубы HGTV
Проект: HGTV Модернизация перил палубы от худшего до первого | История болезни Дурадек №185
Проблема: протечка террасы в гараж из-за уязвимых стоек, установленных на поверхности
Эта поверхность настила примыкала к наклонной крыше гаража, не оставляя фасции для крепления перил. Перила монтировались на поверхности и крепились болтами прямо через гидроизоляцию палубы. Это сделало гараж внизу уязвимым для утечек и повреждения водой.
Это сделало гараж внизу уязвимым для утечек и повреждения водой.
У домовладельцев была возможность принять участие в программе HGTV «От худшего к первому» за полную реконструкцию дома, которая включала в себя их террасу над гаражом.
Группа экспертов The Worst to First была знакома с Дурадеком. Они знали, что опыт Duradek и Durarail в области гидроизоляции позволит им получить террасу, не требующую особого ухода, которая защитит дом от проникновения влаги.
Эта палуба нуждалась в реконструкции, включая обновление перил с профессиональной установкой.
Duradek отправила обученного и авторизованного установщика, у которого было решение, рекомендованное Duradek для ограждений, устанавливаемых на поверхность. Это защитит перила и не нарушит целостность водонепроницаемой виниловой мембраны.
Решение Durarail: модернизированные поручни, установленные на приподнятых опорных плитах
Для наиболее эффективной гидроизоляции ограждений, монтируемых на поверхность, монтажник Duradek включил приподнятые опорные плиты. Когда стойки перил крепятся к приподнятым опорным плитам, вода не может осесть там, где винты крепят стойки, что является уязвимым местом для гидроизоляции.
Когда стойки перил крепятся к приподнятым опорным плитам, вода не может осесть там, где винты крепят стойки, что является уязвимым местом для гидроизоляции.
Опорные пластины были вырезаны из композитной древесины ПВХ и помещены поверх виниловой мембраны, где будут установлены стойки для перил. Отверстие диаметром 1/2 дюйма было размещено в виниле под опорными пластинами, чтобы обеспечить диффузию пара в случае проникновения влаги в резьбовые отверстия. Опорные плиты были обработаны путем герметизации их тем же винилом, что и поверхность деки, с помощью тепловой сварки на месте.
Модернизация перил в этом проекте включала установку перил на поверхности на водонепроницаемых приподнятых опорных плитах.
Стойки для перил были установлены поверх поднятых опорных плит, обернутых виниловой пленкой, с крепежными элементами, проходящими к поверхности настила. Гидроизоляционная целостность виниловой мембраны не пострадала и не была нарушена установкой перил.
ПРИМЕЧАНИЯ К РАБОТЕ
Система остекления без верха позволяет устанавливать стеклянные вставки с достаточным зазором снизу для легкой очистки. Вставки из дымчатого стекла были выбраны, чтобы обеспечить дополнительный элемент уединения с большим количеством света.
Вставки из дымчатого стекла были выбраны, чтобы обеспечить дополнительный элемент уединения с большим количеством света.
Посмотреть или загрузить файл .pdf-версия Case History #185 с фотографиями проекта и информацией об установщике.
Крышная прокладка из EPDM для основания противовеса SR2K — Предотвращает повреждение крыш — Для длительного воздействия резиновой мембранной крыши — BlueWaterMFG 100034
Описание
24″ x 24″ Крышная прокладка из EPDM
100034 Крыша из EPDM 24″ х 3/8″. Для длительного воздействия на резиновую мембранную крышу.
Поручень безопасности 2000 — система защиты от падения
Поручень безопасности 2000 представляет собой простую в использовании портативную систему ограждения, предназначенную для установки и разборки в зависимости от рабочей площадки.Уникальная конструкция устраняет как стоимость, так и опасность по сравнению с промежуточным противовесом, обычно используемым в других (меньших) системах ограждения. SR2000 — это просто набор направляющих и оснований, установленных вокруг рабочей зоны на возвышении для предотвращения травм.
SR2000 — это просто набор направляющих и оснований, установленных вокруг рабочей зоны на возвышении для предотвращения травм.
Каждый комплект включает: 1 секцию направляющей, 1 основание и стопорные штифты.
Установка проста: 1-2-3.
Лучшая часть системы Safety Rail 2000 — это простота ее настройки и разбивки в соответствии с требованиями работы.
- Разместите основания вокруг рабочей зоны
- Вставьте направляющие в порты основания
- Вставьте фиксирующие штифты и зафиксируйте основание на месте
Трое рабочих могут установить 600-футовое ограждение менее чем за час.
Продается с различной шириной направляющих
Уникальные крыши и приподнятые платформы требуют использования различных комбинаций ширины направляющих. Секции рельсов изготовлены из стальных труб диаметром 1-5/8 дюйма. Каждое основание имеет 4 отверстия, что позволяет размещать рельсы в бесконечном количестве положений. Каждое основание может поддерживать до 4 направляющих, ворот в сборе и дополнительных кронштейнов для бортов.
Каждое основание может поддерживать до 4 направляющих, ворот в сборе и дополнительных кронштейнов для бортов.
Все направляющие соответствуют требованиям OSHA к высоте 42 дюйма для верхних и 21,5 дюймов для средних направляющих.
Для ограждения SR2000 требуется основание
Для системы предохранительных ограждений 2000 требуется, чтобы каждое ограждение было уравновешено основанием для предотвращения возможных падений с приподнятых платформ. В непроникающей конструкции используется чугунное основание весом 108 фунтов для поддержки перил и любого человека, который может в них упасть.Эта уникальная конструкция сводит к минимуму опасность споткнуться, поскольку устраняет необходимость в промежуточном противовесе. Все базы имеют четыре порта, что позволяет устанавливать рельс любым способом. Каждое основание может поддерживать до 4 направляющих.
Создайте собственную систему ограждений для крыш
Преимущество ограждения 2000 – универсальность и модульная конструкция ограждения и основания.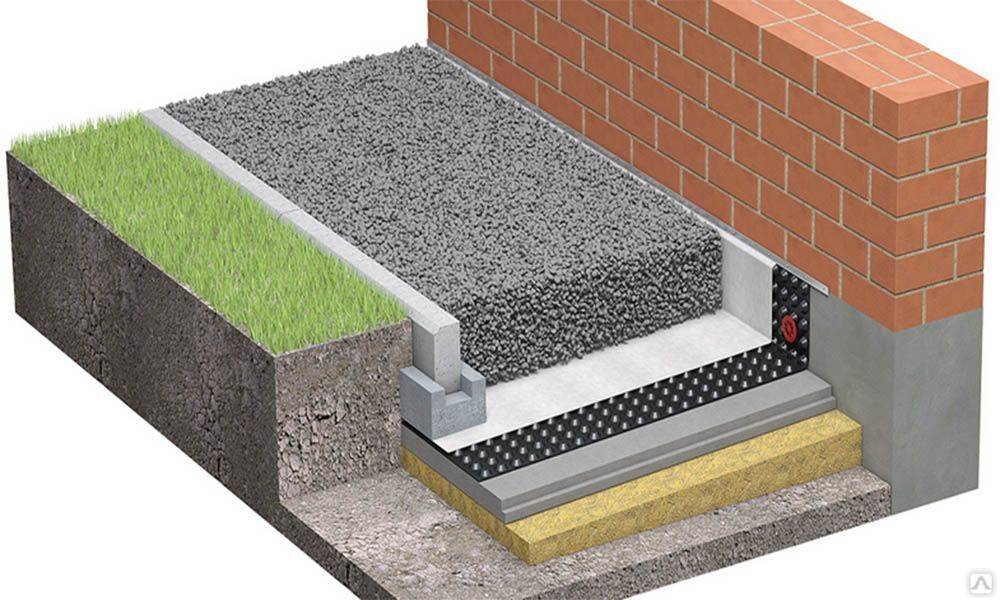

 избежать затрат времени на устройство бетонной подготовки.
избежать затрат времени на устройство бетонной подготовки. KG)
KG)
 Для связывания арматуры можно использовать пластиковые хомуты. Узлы, связывающие арматуру в монолитных конструкциях, не несут никакой нагрузки, соединения фиксируются только для того, чтобы придать форму на момент заливки бетоном.
Для связывания арматуры можно использовать пластиковые хомуты. Узлы, связывающие арматуру в монолитных конструкциях, не несут никакой нагрузки, соединения фиксируются только для того, чтобы придать форму на момент заливки бетоном.

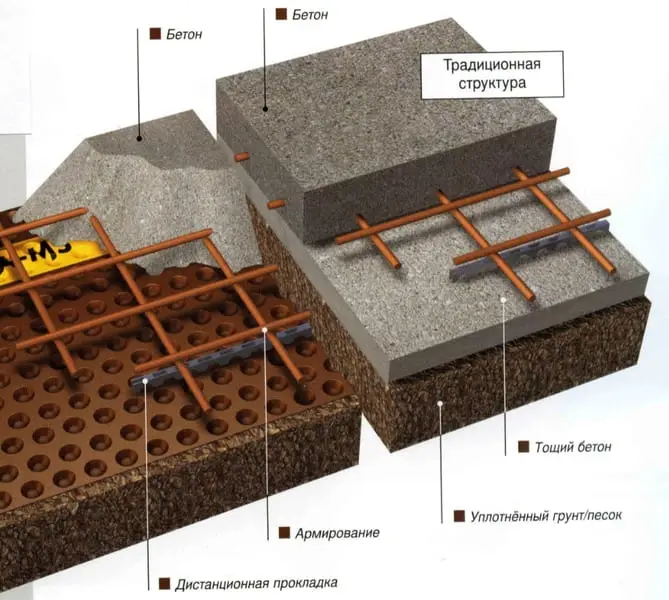

 пмид:24384601
пмид:24384601  22: 498–507. пмид:25042941
22: 498–507. пмид:25042941  Клеточный микроб-хозяин. 15: 9–21. пмид:24332978
Клеточный микроб-хозяин. 15: 9–21. пмид:24332978  Г., Баслер М., Рамагопал Ю.А., Бонанно Дж.Б., Саудер Дж.М. и др. (2009) Аппарат секреции типа VI и белковые комплексы, связанные с фаговым хвостом, имеют общее эволюционное происхождение. Proc Natl Acad Sci USA. 106: 4154–9. пмид:19251641
Г., Баслер М., Рамагопал Ю.А., Бонанно Дж.Б., Саудер Дж.М. и др. (2009) Аппарат секреции типа VI и белковые комплексы, связанные с фаговым хвостом, имеют общее эволюционное происхождение. Proc Natl Acad Sci USA. 106: 4154–9. пмид:19251641  106: 4067–8. пмид:19276114
106: 4067–8. пмид:19276114 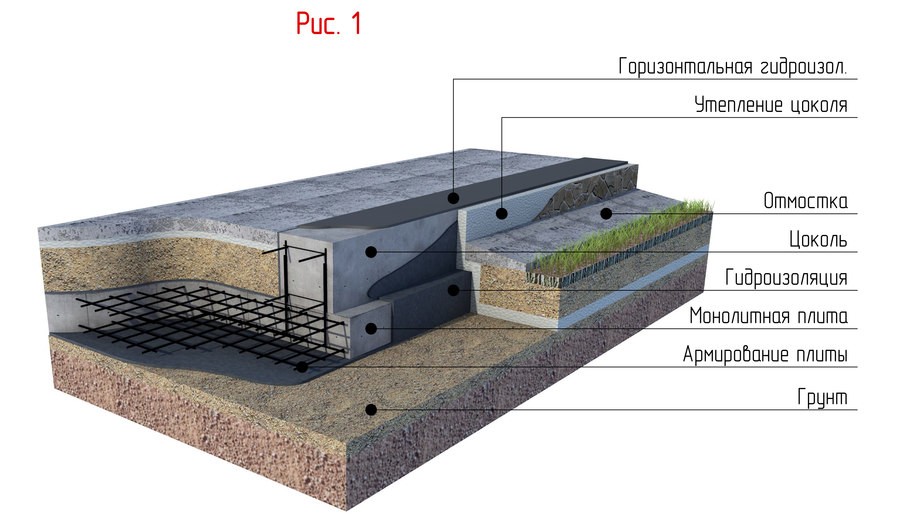 Природа. 483: 182–6. пмид:22367545
Природа. 483: 182–6. пмид:22367545  Дж., Костюченко В.А., Аксюк А.А., и соавт.(2010)Морфогенез хвоста Т4 и хвостовых волокон. Вирол Дж. 7: 355. pmid:21129200
Дж., Костюченко В.А., Аксюк А.А., и соавт.(2010)Морфогенез хвоста Т4 и хвостовых волокон. Вирол Дж. 7: 355. pmid:21129200  Анну Рев Микробиол. 66: 453–72. пмид:22746332
Анну Рев Микробиол. 66: 453–72. пмид:22746332  33: W244–8. пмид:15980461
33: W244–8. пмид:15980461  Биохим Дж. 461: 291–304.пмид:24779861
Биохим Дж. 461: 291–304.пмид:24779861  пмид:10829079
пмид:10829079 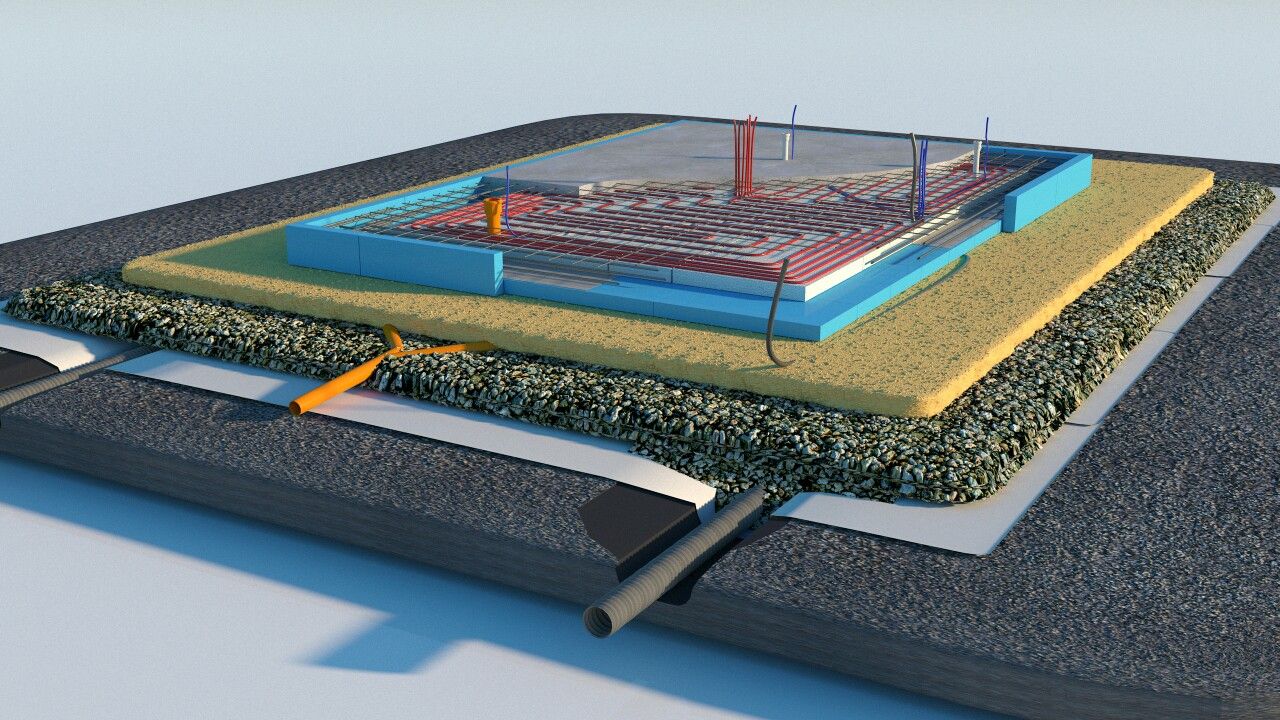 Методы. 58: 325–34. пмид:22841567
Методы. 58: 325–34. пмид:22841567